Revisão
Avaliação química e biológica de Graphium jumulu, fungo endofítico de Duroia macrophylla Huber (Rubiaceae)
Chemical and biological evaluation of Graphium jumulu, endophytic fungus of Duroia macrophylla Huber (Rubiaceae)
Resumo
O presente trabalho investigou o potencial biotecnológico do fungo endofítico Graphium jumulu. O fungo foi cultivado em meio caldo de batata suplementado com 0,2% de extrato de levedura, em agitação a 120 rpm, a 30°C durante 20 dias, sendo os metabólitos do micélio extraídos com acetato de etila em banho ultrassom. O extrato foi testado para as atividades de toxicidade, antioxidante e antibacteriana, e não demonstrou efeito tóxico e nem atividade antioxidante, apresentando somente atividade antibacteriana, o que levou a seu fracionamento e, posterior, isolamento da substância: 4,9-dihidroxi-1,2,11,12-tetrahidroperileno-3,10-quinona. Esta substância foi testada frente as cepas patogênicas Acinetobacter baumannii, Aeromonas hydrophila, Edwardsiella tarda, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Pseudomonas fluorescens, Salmonella enteritidis, Serratia marcencens, Staphylococcus aureus. A substância não inibiu nenhuma das cepas avaliadas, entretanto estimulou o crescimento bacteriano de todas, com destaque para S. aureus, A. baumannii e S. enteritidis, que apresentaram um crescimento de forma linear crescente em função da concentração da substância. Concluiu-se que a 4,9-dihidroxi-1, 2,11,12-tetrahidroperileno-3,10-quinona é um potencial estimulador do crescimento microbiano sugerindo a continuidade de avaliações frente a outras bactérias de interesse clínico e de interesse industrial. Este é o primeiro relato desta substância no fungo endofítico G. jumulu.
- Palavras-chave:
- Bioprospecção.
- Graphium jumulu.
- Atividade antibacteriana.
- Perileno quinona.
Abstract
The present work investigated the biotechnological potential of the endophytic fungus Graphium jumulu. The fungus was grown in potato broth supplemented with 0.2% yeast extract in a shaker incubator at 120 rpm at 30ºC for 20 days, the metabolites of the mycelium being extracted with ethyl acetate in an ultrasound bath. The extract was tested for toxicity, antioxidant and antibacterial activities. The extract did not show a toxic and antioxidant effect, showing only antibacterial activity, which led to its fractionation and subsequent isolation of the substance: 4,9-dihydroxy-1,2,11,12-tetrahydroperylene-3,10-quinone. This was tested against the pathogenic strains Staphylococcus aureus, Salmonella enteritidis, Aeromonas hydrophila, Pseudomonas fluorescens, Klebsiella pneumoniae, Edwardsiella tarda, Acinetobacter baumannii, Serratia marcencens, Pseudomonas aeruginosa, Escherichia coli. The substance did not inhibit any of the strains evaluated, but stimulated bacterial growth of all, with emphasis on S. aureus, A. baumannii and S. enteritidis, which presented a linear growth as function of the substance's concentration. It is concluded that 4,9-dihydroxy-1,2,11,12-tetrahydroperylene-3,10-quinone is a potential microbial growth stimulant suggesting the continuity of evaluations against other bacteria of clinical interest and of industrial interest. This is the first report of this substance in the endophytic fungus Graphium jumulu.
- Keywords:
- Bioprospection.
- Graphium jumulu.
- Antibacterial activity.
- Perylene quinone.
Introdução
Microrganismos que residem nas plantas, cada vez mais, estão se tornando objeto dos esforços em pesquisa, visto que os mesmos demonstram capacidade de produzir substâncias com atividades antioxidantes, antibacterianas e tóxicas [1,2]. Uma característica adicional importante é que essas moléculas são altamente seletivas e específicas baseadas nos mecanismos de ação [3].
As habilidades de produção de substâncias conferidas aos fungos endofíticos podem ser justificadas pela interação com a planta hospedeira com a possível troca de material genético [4]. Consequentemente, a microbiota endofítica pode produzir substâncias elicitoras, que atuam no desenvolvimento da planta hospedeira ou de outros microrganismos que estejam na condição endofítica, como também podem desempenhar atividade antibiótica frente a microrganismos invasores [5-7]. Na literatura pesquisada, a maioria dos endófitos que produzem antibióticos pertence ao filo Ascomycota. Dentro dessa classe estão os fungos pertencentes ao gênero Graphium [8].
Trabalhos científicos comprovam a produção de metabólitos secundários por espécies do gênero Graphium, apresentando estruturas químicas inéditas e substâncias antimicrobianas com notado destaque, tais como a hipoxisordarina, ovalicina, zofimarina [9-12]. Ainda assim, esse gênero compreende um grupo de fungos mal caracterizado quanto ao potencial biotecnológico.
Em pesquisas realizadas com fungos endofíticos é extremamente importante o conhecimento prévio a respeito do histórico químico e biológico da planta hospedeira. Estudos com Duroia macrophylla Huber (Rubiaceae) confirmaram atividade tóxica frente a Artemia salina, significativa atividade antioxidante, atividade antibacteriana e antimicobacteriana [13-15]. Dessa forma, considerando que os fungos endofíticos possam produzir substâncias semelhantes às de seus hospedeiros, o presente trabalho teve como objetivo explorar o potencial biotecnológico do fungo endofítico Graphium jumulu, isolado da planta Duroia macrophylla, quanto à produção de substâncias de interesse clínico e industrial.
Material e Métodos
Isolamento e cultivo
A espécie fúngica foi isolada de folhas de Duroia macrophylla coletadas em maio de 2013, na reserva ambiental Adolpho Ducke Manaus-AM. O fungo foi identificado na fundação André Tosello, usando amplificação de DNA da região ITS (ITS1-5.8s-ITS2) rDNA, a identificação apontou como sendo Graphium jumulu.
O micélio foi cultivado em placas Petri contendo Batata Dextrose Agar (BDA) e inoculado em 10 frascos Erlenmeyer de 250 mL contendo 100 mL de meio de cultura de Dextrose Batata Caldo adicionado de 0,2% de extrato de levedura (BDL). Os frascos foram colocados em um agitador orbital (Tecnal) a 30°C, com agitação a 120 rpm durante 20 dias.
Obtenção de extrato
O micélio foi seco em estufa a < 40ºC por 3 dias. O material seco (3 g) foi macerado em almofariz e colocado em Erlenmeyer. Após, foi imerso em 100 mL de acetato de etila (AcOEt) e extraído usando banho ultrassom (UNIQUE, modelo USC-2800, 40 Hz) por 20 minutos. O material foi filtrado e re-extraído com AcOEt e ultrassom, o procedimento foi repetido três vezes cada extração.
Bioensaios com extrato AcoEt
Atividade antioxidante
A solução do ácido ascórbico foi preparada com 44 mg diluída em 50 mL de água deionizada. A partir desta solução foram feitas diluições com as seguintes concentrações: 0, 88, 176, 352, 526, e 704 g/mL. Para o preparo da solução de 2,2-difenil-1-picril-hidrazila (DPPH) foram solubilizados 28 mg do mesmo em 1 mL de diclorometano (DCM), posteriormente foi adicionado MeOH até atingir o volume de 100 mL. Para o preparo da solução de Fe3+, 8,6344 g de sulfato férrico foi diluído em uma solução de ácido clorídrico (HCl) 1% (v/v), onde, posteriormente, a solução foi transferida para um balão volumétrico com capacidade de 1 L. Após a dissolução o volume restante foi preenchido com a solução de ácido clorídrico. Para a visualização da ação oxidante do ferro, foi utilizado 1,10-fenatrolina, sendo preparada uma solução com 0,25 g de 1,10-fenantrolina diluídos em solução tampão de acetato de sódio (pH 4,5) com volume total de 100 mL.
Foram feitas curvas-padrão, com ácido ascórbico, para cada agente oxidante: para curva com DPPH, foram adicionados em seis microtubos 990 μL de DPPH e 10 µL de ascórbico nas diferentes concentrações, sendo realizadas as leituras de absorbância após 30 minutos em espectrofotômetro no comprimento de onda de 517 nm. Para a curva com o ferro foram adicionados 10 µL do ácido ascórbico diluído em seis microtubos, em seguida 10 µL de Fe3+ e por fim, 980 μL de 1,10-fenantrolina, sendo realizadas leituras de absorbância após uma hora em espectrofotômetro no comprimento de onda de 508 nm. Os dados foram registrados em uma planilha que mostra a linearidade da curva.
Para a análise do extrato, 5 mg foram solubilizados em acetato de etila, transferidos para um balão volumétrico e avolumados até 10 mL. Para o teste com DPPH foram transferidos 10 μL da amostra para um microtubo seguido pela adição de 990 μL da solução DPPH, onde a mistura foi homogeneizada. Após por 30 minutos aferiu-se a absorbância em comprimento de onda de 517 nm. Para o teste com o ferro foram transferidos 10 μL da solução padrão de Fe3+ com concentração de 1000 μg/mL para um microtubo, seguido pela adição de 10 μL da amostra e 980 μL da solução de 1,10-fenantrolina 0,25% (m/v), onde a mistura foi homogeneizada. Após uma hora, foi medida a absorbância em comprimento de onda de 508 nm.
Realizou-se um teste controle para cada tipo de agente oxidante, onde o controle foi preparado da mesma forma como as amostras, substituindo-se a amostra por água deionizada [16].
Ensaio de toxicidade em Artemia salina
Para o ensaio de toxicidade realizou-se o seguinte procedimento: pesaram-se 38 g de sal marinho, solubilizados em 1 L de água destilada, sendo esta solução posteriormente filtrada; adicionou-se 10 mg de cistos de Artemia salina, os quais foram deixados sob luz artificial por 48 horas em temperatura ambiente; pesou-se 10 mg de cada extrato, que foram dissolvidos em 1 mL de dimetilsulfóxido (DMSO).
Os ensaios foram realizados em placa de 24 poços, sendo que cada poço primeiramente recebeu 1 mL de água salina contendo A. salina (10 indivíduos por poço). Posteriormente, foram adicionadas diferentes concentrações dos extratos em triplicata, além de um controle salino e um controle do solvente DMSO. A placa foi incubada por 24 h sob luz artificial e temperatura ambiente. Após o decorrido tempo, contou-se manualmente os indivíduos vivos e os mortos.
Ensaio antibacteriano por difusão em ágar
Em Placas de Petri contendo Ágar Mueller-Hinton, foram feitas cavidades de 6 mm de diâmetro nas quais foram depositadas alíquotas de 100 µL do extrato com concentração de 5 mg/mL. Nessas placas foram inoculados os micro-organismos testes sendo esses: Aeromonas hydrophila (ATCC 7966), Bacillus cereus (ATCC 14579), Edwardsiella tarda (ATCC 15947), Escherichia coli (ATCC 11775), Klebsiella pneumoniae (ATCC 13883), Nocardia brasiliensis (ATCC 19296), Providencia rettgeri (ATCC 29944), Pseudomonas aeruginosa (ATCC 10145), Pseudomonas fluorescens (ATCC 13525), Salmonella enteritidis (ATCC 13076), Serratia marcescens (ATCC 13880), Staphylococcus aureus (ATCC 12600).
Posteriormente, as placas foram colocadas em estufa de crescimento bacteriológico por 24 horas e, passado esse período, realizou-se a medição dos halos (em mm). A aferição dos diâmetros foi medida com paquímetro.
Utilizou-se antibiótico oxitetraciclina na concentração de 125 µg/mL como controle positivo.
Fracionamento cromatográfico do extrato
Foram utilizados 200 mg do extrato bruto de AcOEt para o fracionamento. Utilizou-se uma coluna cromatográfica aberta (hxØ = 25 x 1,4 cm) utilizando sílica gel (Sigma) e sistemas de eluição em gradiente: hexano/diclorometano (1:1, 4:6, 3:7), diclorometano (100%), diclorometano/ AcOEt (9:1, 8:2, 7:3, 1:1), 100% de AcOEt; AcOEt/metanol (1:1) e 100% de metanol, cada sistema de eluição consistiu em volume de 100 mL. A proporção usada foi de 1:100 (massa de extrato/massa de sílica). As frações obtidas foram analisadas por cromatografia em camada delgada comparativa (CCDC), utilizando luz ultravioleta (λ de 254 nm e 365 nm) e Ce(SO4)2
Ressonância magnética nuclear
Os espectros de RMN, uni e bidimensionais de 1H e 13C, foram obtidos no espectrômetro Bruker Fourier 300, operando a 300 MHz para o núcleo 1H e a 75 MHz para o núcleo 13C. Usando clorofórmio deuterado para dissolver a amostra e como padrão interno.
Espectrometria de massas
Os espectros de massas de alta resolução foram obtidos em um modelo de espectrômetro de massas UltrOTOFQ (ESI-TOF Mass Spectrometer, Bruker Daltonics) ligado a um sistema de cromatografia (HPLC) coluna ODS 50 x 2,0 mm, concentração da amostra = 1 mg/mL em acetonitrila (ACN); Fluxo = 0,4 mL/min; Inj = 1 L - split de 0,05 mL (MS)/0,29 mL (desc) e P2840 psi. Sistema de eluição A (H2O + 0,1% ácido fórmico)/B (ACN + 0,1% ácido fórmico). Condição de eluição: 0 a 10 min - 50% de B, de 10 a 11 min - 50 a 100% de B, de 11 a 12 min - 100% de B, de 12 a 13 min - 100 a 50% de B e de 13 a 14 min 50% de B.
Ensaio de atividade antibacteriana com a substância isolada
Para a avaliação da atividade antibacteriana, a substância foi testada frente às seguintes cepas: Acinetobacter baumannii (ATCC 19606), A. hydrophila (ATCC 7966), E. coli (ATCC 11775), E. tarda (ATCC 15947), K. pneumoniae (ATCC 13883), P. aeruginosa (ATCC 10145), P. fluorescens (ATCC 13525), S. enteritidis (ATCC 13076), S. marcencens (ATCC 13880), S. aureus (ATCC 12600).
As cepas foram escolhidas de acordo com sua importância clínica. O ensaio foi realizado segundo metodologia descrita pelo NCCLS - National Committee for Clinical Laboratory Standards[17].
Os micro-organismos utilizados no ensaio foram cultivados em meio líquido Mueller-Hinton e posteriormente diluídos no próprio meio até a concentração de 0,5 na escala de McFarland. Os extratos foram diluídos em dimetilssulfóxido (5%) nas concentrações de 125; 62,5; 31,25; 15,62 μg/mL. Os micro-organismos foram inoculados em placas de 96 poços (em triplicata) juntamente com as diferentes diluições da substância, e mantidos em estufa bacteriológica com temperatura controlada (30ºC) durante 24 horas.
Foi utilizado como controle negativo o solvente usado e o micro-organismo, enquanto para o controle positivo foi usando o antibiótico e o micro-organismo. Também foi realizado um controle branco contendo somente o meio líquido.
As leituras das placas foram feitas em espectrofotômetro com absorbância no comprimento de onda de 625 nanômetros. O teste foi realizado em triplicada e os dados submetidos à análise de variância (ANOVA) simples, seguido da comparação de média pelo teste Dunnet, considerando um intervalo de confiança de 95% (p < 0,05), utilizando o software estatístico GraphPad Prism.
Resultados e Discussão
Nos ensaios de antioxidante e de toxicidade as concentrações utilizadas não demonstraram atividade. A toxicidade em A. salina é utilizada como indicativo preliminar quanto a potencialidade do extrato em testes antitumorais. Por outro lado, o efeito não tóxico também é importante, pois, espera-se que as células normais provavelmente não sejam intoxicadas por componentes do extrato [18].
Ensaio da atividade antibacteriana do extrato AcOEt
No resultado do ensaio de atividade antibacteriana por difusão, o extrato AcOEt apresentou atividade mediana frente a sete bactérias, conforme apresentado na TABELA 1.
| Microrganismos teste | Halos de inibição (mm) |
| Aeromonas hydrophila | - |
| Bacillus cereus | - |
| Edwardsiella tarda | 8 |
| Escherichia coli | 9 |
| Klebsiella pneumoniae | - |
| Nocardia brasiliensis | - |
| Providencia rettgeri | 7 |
| Pseudomonas aeruginosa | 7 |
| Pseudomonas fluorescens | - |
| Salmonella enteritidis | 9 |
| Serratia marcescens | 10,1 |
| Staphylococcus aureus | - |
| Legenda: Classificação da atividade de extratos considerando halos de inibição (mm): 1-6 baixa atividade, 7-13 média atividade, > 13 alta atividade [19]. | |
Por se tratar de extrato bruto, consideram-se duas possibilidades que justifiquem a atividade ou falta dela. A primeira é o sinergismo, onde a interação de duas ou mais substâncias resultam na atividade agonista ou antagonista frente um organismo teste [20]. Outra possibilidade refere-se à ação de uma única substância sendo responsável pela bioatividade.
Análise química das frações
O fracionamento do extrato AcOEt resultou em 182 frações, reunindo-se as frações 27 a 33. Ao revelar a CCDC das frações 27 a 33 com luz UV nos comprimentos de onda 254 e 365 nm observou-se a presença de cromóforos emitindo fluorescência, e quando revelado com o revelador químico Ce(SO4)2 observou-se a presença de uma mancha na cor laranja.
A análise dos espectros de RMN de 1H revelou a presença de apenas 4 sinais, dois na região aromática (7,30 e 8,7 ppm) ambos d com J = 9,3 Hz e com integral para 1H e outros dois sinais na região alifática em 3,00 e 3,45 ppm com integral para 2H sendo ambos t com J = 7,0 Hz. Os espectros bidimensionais mostraram a presença de 11 C. O espectro de massa apresentou um pico com m/z de 319,0964 sugerindo a fórmula molecular C20H14O4. As correlações foram feitas com base nas informações observadas nos espectros bidimensionais HSQC e HMBC (TABELA 2).
| Posição | 13C (ppm)* | 1H (ppm) | HMBC |
| 1, 12 | 24,6 | 3,45 (2H, t, J = 7,0 Hz) | C-2, C-3, C-12b, C-12ª |
| 2, 11 | 36,4 | 3,00 (2H, t, J = 7,0 Hz) | C-1, C-3, C-12ª |
| 3, 10 | 203,6 | ||
| 3a, 9a | 111,0 | ||
| 4, 9 | 162,2 | ||
| 5, 8 | 118,8 | 7,30 (1H, d, J = 9,3 Hz) | C-3a, C-6ª |
| 6, 7 | 131,7 | 8,70 (1H, d, J = 9,3 Hz) | C-4, C-3b, C-6ª |
| 6a, 6b | 122,0 | ||
| 3b, 6c | 121,7 | ||
| 12a | 129,0 | ||
| 12b | 129,8 | ||
| 4, 9 – OH | 13,19 (1H, s) | C-4, C-5, C-3ª | |
| Legenda: *sinais obtidos da análise do mapa de correlação HSQC. | |||
A análise dos espectros indicou se tratar da substância 4,9-dihidroxi-1,2,11,12-tetrahidroperileno-3,10-quinona (FIGURA 1). Esta substância foi descrita pela primeira vez por Li et al. [21], sendo produzida pelo fungo Bulgaria inquinans. Este é o primeiro relato da substância isolada do fungo Graphium jumulu.
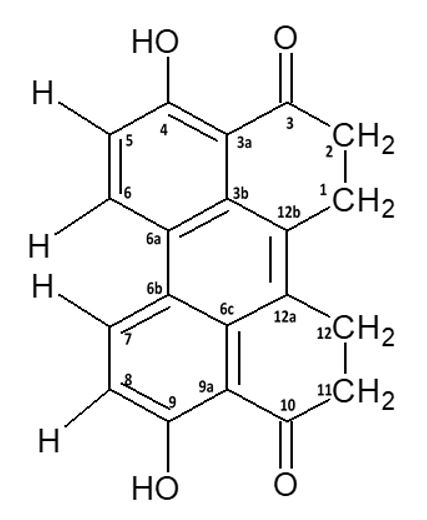
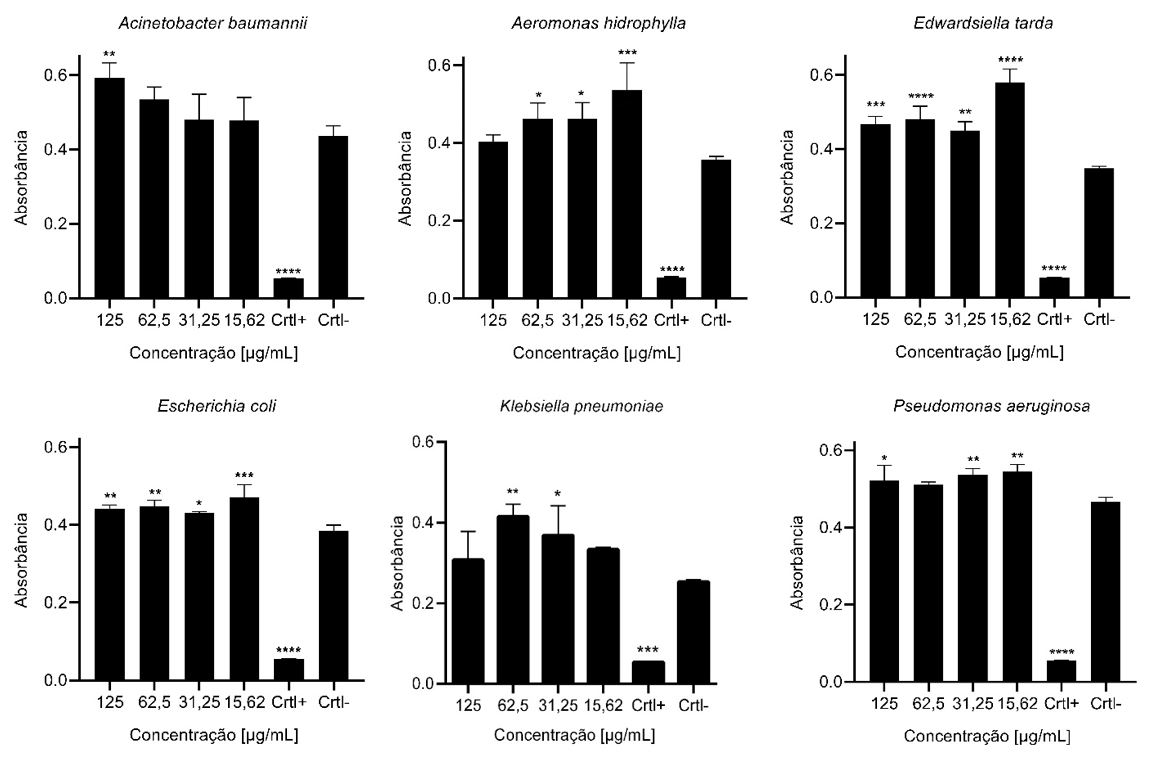
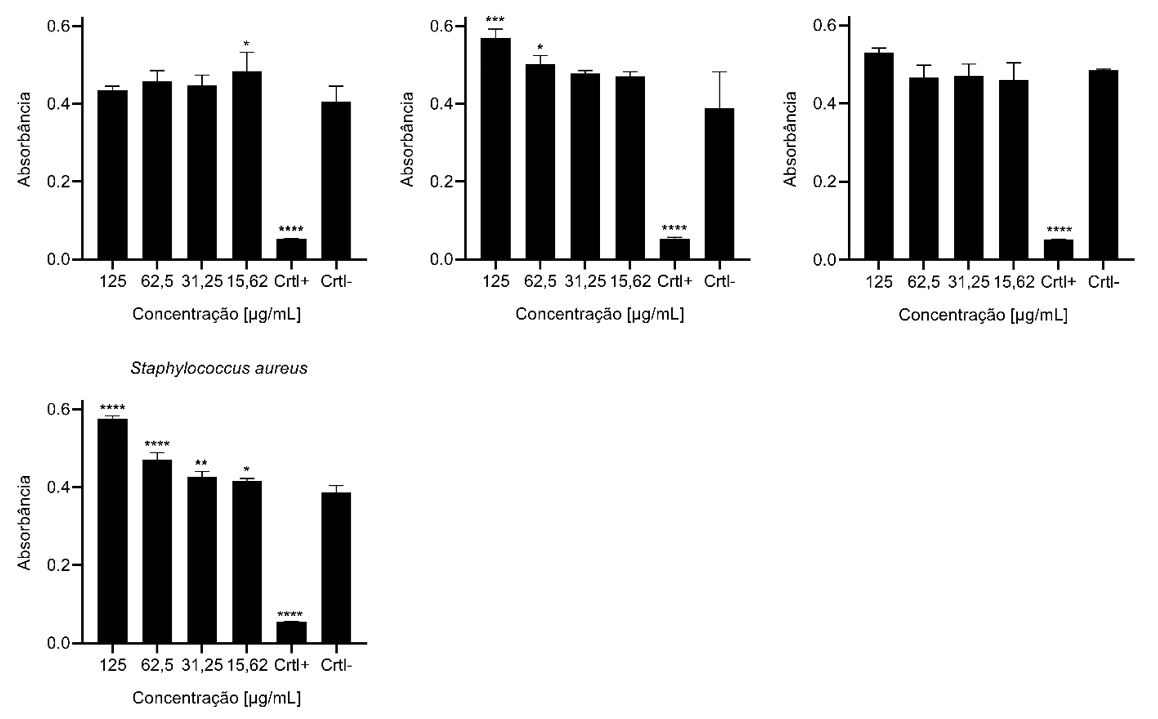
No ensaio antibacteriano por concentração inibitória mínima, nenhuma das concentrações da substância foi capaz de inibir o crescimento bacteriano das cepas testadas, conforme mostrado na FIGURA 2. Em contrapartida, foi possível observar que houve estímulo no crescimento de todas as bactérias. As porcentagens de crescimento foram estabelecidas com base nas médias dos controles negativos. Com destaque para as bactérias que apresentaram crescimento linear em função das concentrações da substância. Staphylococcus aureus onde foi observado um crescimento de 49% na concentração de 125 µg/mL, declinando para 7% na concentração de 15,62 µg/mL. Salmonella enteritidis em 125 µg/mL o crescimento foi de 46% em 15,62 µg/mL de 21%. Para Acinetobacter baumannii em 125 µg/mL o crescimento foi de 36% atenuando para a concentração de 15,62 g/mL o qual apresentou 9%.
A dinâmica da interação química entre as substâncias podem afetar o crescimento de microrganismos de duas maneiras: promovendo a inibição do desenvolvimento celular a exemplo disso são os antibióticos [22], e outra situação, onde pode ocorrer a estimulação do crescimento microbiano mediada por nutrientes essenciais à multiplicação celular como: vitaminas, aminoácidos, lipídios, elementos inorgânicos [23]. Algumas quinonas têm sido relatadas na literatura como moduladoras do crescimento vegetal e microbiano atuando como estimuladoras [24,25]. O estudo de Ameyama et al. [26] verificou que a substância pirroloquinolina quinona atuou como coenzima, aumentando significativamente o crescimento bacteriano. Fenn et al. [27] também verificaram que menaquinonas são uma classe importante que podem promover o crescimento de diversas bactérias do microbioma intestinal humano.
A 4,9-dihidroxi-1,2,11,12-tetrahidroperileno-3,10-quinona isolada neste trabalho, assim como outras quinonas já relatadas na literatura, apresenta potencial como fator de crescimento podendo ser empregada no cultivo de cepas de interesse biotecnológico ou clínico, cujo o cultivo em condições laboratoriais é limitado.
Conclusão
O fracionamento do extrato bruto de AcOEt do micélio permitiu o isolamento da substância 4,9-dihidroxi-1,2,11,12-tetrahidroperileno-3,10-quinona. Sendo o primeiro relato dessa substância no fungo Graphium jumulu, o que contribui com o conhecimento sobre a composição química dessa espécie.
A substância isolada não apresentou atividade inibitória contra as bactérias avaliadas no ensaio, sendo que, pelo contrário, aumentou o crescimento de todas as cepas testadas. Estes resultados sugerem que esta substância possa ser avaliada frente a outras cepas de interesse médico, talvez como estimulador da microbiota intestinal ou, ainda, como estimuladora para ser acrescida em meios de cultura em bioprocessos.
Agradecimentos
Os autores agradecem ao CNPq (projetos: PPBio/CNPq, REPENSA/CNPq/FAPEAM, CT-Agro/CNPq, CT-Amazônia/CNPq), à CAPES (projeto: Pro-Amazônia/CAPES) e à FAPEAM (REPENSA/CNPq/FAPEAM), pelo apoio financeiro e bolsas concedidas.
Referências
1. Lu Y, Chen S, Wang B. Cytotoxic activities of endophytic fungi isolated from the endangered, Chinese endemic species Dysosma pleiantha. Z Naturforschung C J Biosci. 2009; 64(7-8): 518-520. ISSN 0939-5075. [CrossRef] [PubMed].
2. Gunasekaran S, Sathiavelu M, Arunachalam S. In vitro antioxidant and antibacterial activity of endophytic fungi isolated from Mussaenda luteola. J Appl Pharma Scie. 2017; 7(08): 234-238. ISSN 2231-3354. [CrossRef].
3 Gordon MC, David JN. Natural products: a continuing source of novel drug leads. Biochim Biophys Acta 2013; 1830(6): 3670–3695. ISSN 0304-4165. [CrossRef] [PubMed].
4. Germaine K. et al. Colonisation of poplar trees by gfp expressing bacterial endophytes. FEMS Microbiol Ecol. 2004; 48(1): 109-118. ISSN 1574-6941. [CrossRef] [PubMed].
5. Santos MLD, Berlitz DL, Wiest SLF, Schünemann R, Knaak N, Fiuza LM. Benefits associated with the interaction of endophytic bacteria and plants. Braz Arch Biol Technol. 2018; 61. ISSN 1678-4324. [CrossRef].
6. Guo B, Wang Y, Sun X, Tang K. Bioactive natural products from endophytes: a review. Appl Biochem Microbiol. 2008; 44(2): 136-142. ISSN 1608-3024. [CrossRef] [PubMed].
7. Batista BN, Raposo NVM, Silva IR. Isolamento e avaliação da atividade antimicrobiana de fungos endofíticos de açaizeiro. Rev Fitos. Rio de Janeiro. 2018; 12(2): 161-174. ISSN 2446-4775. [CrossRef] [Link].
8. Martinez-Klimova E, Rodríguez-Peña K, Sánchez S. Endophytes as sources of antibiotics. Biochem Pharmacol. 2017; 134: 1-17. ISSN 0006-2952. [CrossRef] [PubMed].
9. Harbone JB, Baxter B, Moss JP. Phytochemical Dictionary: A Handbook of Bioactive Compounds from Plants. 2ª ed. Taylor & Francis Group; 1999. ISBN: 0-7484-0620-4.
10. Bycroft BW, Payne DJ. Dictionary of Antibiotics and Related Substances. 2ª ed. Taylor & Francis Group. 2014; ISBN: 978-1-4398-3952-2.
11. Fukuda T et al. Graphiumins, new thiodiketopiperazines from the marine-derived fungus Graphium sp. OPMF00224 Nat Prod Sci. 2015; 21(4): 255-260. ISSN 2288-9027. [CrossRef] [PubMed].
12. Dhanasekaran D, Thajuddin N, Panneerselvam A. Antimicrobials: Synthetic and Natural Compounds. 1ª ed. Taylor & Francis Group; 2015. ISBN 9781498715621.
13. Martins D. Estudo químico e biológico de Duroia macrophylla Huber (Rubiaceae). 250p. 2014. Tese de Doutorado [Programa de Pós-Graduação em Biotecnologia] Universidade Federal do Amazonas. Manaus.
14. Martins D, et al. Tamizaje fitoquímico y evaluación de las actividades biológicas de Duroia macrophylla (Rubiaceae). J Pharm Pharmacog Res. 2014; 2(6): 158-171. ISSN 0719-4250. [Link].
15. Martins D et al. Triterpenes and the antimycobacterial activity of Duroia macrophylla Huber (Rubiaceae). BioMed research international. 2013; 2013: 7. ID: 605831 [CrossRef] [Link].
16. Novaes JA. Desenvolvimento e validação de método para a quantificação da capacidade redutora de extratos vegetais secos. 31p. 2008. Dissertação de Mestrado [Programa de Pós-Graduação em Biotecnologia e Recursos Naturais da Amazônia] Universidade do Estado do Amazonas. Manaus. 2008.
17. NCCLS - National Committee for Clinical Laboratory Standards. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Sixth Edition. NCCLS document M7-A6. 2003. ISBN: 1-56238-486-4.
18. Silva SL et al. Avaliação da toxicidade aguda pré-clínica do extrato metanólico das cascas do caule de Parahancornia amapa (Apocynaceae). Acta amazônica 2016; 46(1): 73-80. ISSN 1809-4392. [CrossRef].
19. Hu SH, Wang JC, Kung HF, Wang JT, Lee WL, Yang YH. Antimicrobial effect of extracts of cruciferous vegetables. Kaohs J MedSci. 2004; 20(12): 591-599. ISSN 2410-8650 [CrossRef] [PubMed].
20. Tallarida RJ. Quantitative methods for assessing drug synergism. Genes & cancer. 2011; 2(11): 1003-1008. ISSN 1947-6027. [CrossRef] [PubMed].
21. Li PZX, Xu NLJ, Meng DL, Sha YA. New perylenequinone from the fruit bodies of Bulgaria Inquinans. J Asian Nat Prod Res. 2006; 8(8): 743-746. ISSN 1477-2213. [CrossRef] [PubMed].
22. Pande S, Kost C. Bacterial Unculturability and the Formation of Intercellular Metabolic Networks. Trends Microbiol. 2017; 25 (5): 1-13. ISSN 0966-842X. [CrossRef] [PubMed].
23. Tortora GJ, Funke BR, Case CL. Microbiol. 12ª ed. Porto Alegre: Artmed; 2017. ISBN: 978-85-8271-354-9.
24. Rucker R, Chowanadisai W, Nakano M. Potential physiological importance of pyrroloquinoline quinone. Altern Med Rev. 2009; 14(3): 268-277. ISSN 1089-5159. [PubMed] [Link].
25. Ghosh S, Chakraborty R, Raychaudhuri U. Pyrroloquinoline quinone a redox cofactor and its involvement in biological system. Intern J Sci Nat. 2013; 4(3): 371-380. ISSN 2229-6441. [Link].
26. Ameyama M, Shinagawa E, Matsushita K, Adachi O. Growth Stimulating Substance for Microorganisms Produced by Escherichia coli Causing the Reduction of the Lag Phase in Microbial Growth and Identity of the Substance with Pyrroloquinoline Quinone. Agri Biol Chem. 1984; 48(12): 3099-3107. ISSN 0916-8451. [CrossRef] [Link].
27. Fenn K, Strandwitz P, Stewart EJ, Dimise E, Rubin S, Gurubacharya S et al. Quinones are growth factors for the human gut microbiota. Microbiome. 2017; 5(1): 161. ISSN: 2524-6372. [CrossRef] [PubMed].