Artigo de Pesquisa
Estudo químico e avaliação da atividade antimalárica dos galhos de Piranhea trifoliata
Chemical study and antimalarial activity evaluation of branches of Piranhea trifoliata
Resumo
Este trabalho teve como objetivos realizar o estudo químico dos galhos de Piranhea trifoliata (Picrodendraceae) e avaliar o seu potencial antimalárico. Foram realizadas duas coletas no Estado do Pará. O material foi seco, moído e extraído com diclorometano (DCM), metanol (MeOH) e água (H2O). Os extratos DCM e MeOH foram submetidos à análise em cromatografia em camada delgada comparativa (CCDC), e apresentaram características principalmente de terpenos. Do estudo fitoquímico do extrato DCM da 2ª coleta, foi isolada: friedelan-3-ona e do extrato MeOH da 2ª coleta foi isolado: o triterpeno esqualeno, e mistura dos esteroides estigmasterol e β-sitosterol. Quanto à atividade antimalárica, os extratos e as fases dos extratos MeOH foram avaliados in vitro frente ao Plasmodium falciparum, e os extratos MeOH da 1ª e 2ª coletas foram considerados ativos (CI50 = 13,7 µg/mL; CI50 = 5,8 µg/mL, respectivamente). Este trabalho contribuiu para o conhecimento biológico e químico da espécie Piranhea trifoliata e da família Picrodendraceae, sendo este o primeiro relato de atividades biológicas para a espécie em estudo.
- Palavras-chave:
- Picrodendraceae.
- Triterpenos.
- Esteroides.
- Terpenoides.
- Piranhea.
Abstract
The objective of this work was to carry out the chemical study of Piranhea trifoliata (Picrodendraceae) branches and to evaluate their antimalarial potential. Two collections were performed in the State of Pará. The material was dried, ground and extracted with dichloromethane (DCM), methanol (MeOH) and water (H2O). The DCM and MeOH extracts were subjected to comparative thin layer chromatography (TLC) analysis and showed characteristics mainly of terpenes. From the phytochemical study of the second collection DCM extract, it was isolated: friedelan-3-one and the second collection MeOH extract was isolated: the squalene triterpene, and the mixture of the stigmasterol and β-sitosterol steroids. Regarding antimalarial activity, MeOH extracts and phases were evaluated in vitro against Plasmodium falciparum, and MeOH extracts from the 1st and 2nd collections were considered active (IC50 = 13.7 µg/mL; IC50 = 5.8 µg/mL, respectively). This work contributed to the biological and chemical knowledge of the species Piranhea trifoliata and Picrodendraceae family, this being the first report of biological activities for the species under study.
- Keywords:
- Picrodendraceae.
- Triterpenes.
- Steroids.
- Terpenoids.
- Piranhea.
Introdução
A malária é uma das doenças infecciosas mais devastadoras e comuns em todo mundo e uma das principais ameaças em matéria de saúde pública em mais de 90 países[1-3]. Ela é uma doença altamente recorrente em países tropicais e subtropicais[4]. É uma das doenças negligenciadas de países subdesenvolvidos.
Em 2015, foram relatados 212 milhões de casos clínicos e 429 mil mortes, ocorrendo em grávidas e, principalmente em crianças, sendo que, de acordo com a OMS[5] 78% dos casos fatais ocorreram em crianças menores de 5 anos de idade, dados estes observados no continente africano. Os tratamentos utilizados após o diagnóstico da doença geralmente incluem dois medicamentos associados que causam alguns efeitos colaterais e têm pouca adesão do paciente[6]. Este tratamento é bastante complexo, longo e muitas vezes ineficaz devido à reinfecção do paciente, muito comum nas áreas de incidência da doença[7].
A ineficácia do tratamento antimalárico disponível é a principal razão por trás da sua ameaça. Esse grande problema está na resistência do Plasmodium falciparum, aos fármacos existentes e a toxicidade de drogas em seres humanos[8-11]. As principais drogas antimaláricas atualmente utilizadas são divididas em quatro categorias: quinolinas (quinina, cloroquina, amodiaquina, mefloquina e primaquina), antifolatos (pirimetamina, proguanil e sulfadoxina), derivados da artemisinina (artemisinina, artesunato, arteméter e arteéter) e hidroxinaftoquinonas (atovaquina)[12].
Porém, devido às dificuldades de acesso encontradas para o tratamento da doença, parte da população utiliza plantas medicinais no tratamento da malária. E algumas plantas já demonstraram o seu potencial para fornecer substâncias eficazes para o tratamento da doença, tais como a quinina e artemisinina, as quais foram isoladas de plantas. O que gera um interesse em procurar nas plantas novas alternativas terapêuticas com eficácia igual ou superior às já existentes[1].
O surgimento de cepas de P. falciparum resistentes a quase todos os antimaláricos levaram químicos e biólogos a estudar a sua substituição efetiva com um mecanismo de ação alternativo e novas moléculas[13]. Dentro destas perspectivas, pesquisas em busca de novas substâncias bioativas extraídas de plantas medicinais se tornaram um importante ponto a ser considerado.
Nesta busca de novos antimaláricos extraídos de plantas, podemos destacar o gênero Piranhea, do qual há estudos fitoquímicos relatados na literatura da espécie P. mexicana pela sinonímia Celaenodendron mexicana, da qual foram realizados estudos químicos e isolados terpenos. Também foi relatada que esta espécie é utilizada por índios mexicanos como antisséptico, possui atividade antimalárica, citotóxica e antiprotozoária[14-16]. Assim, o gênero Piranhea é uma fonte promissora de terpenos, e possui um potencial antimalárico, deste modo estudos de novas espécies de Piranhea fazem-se necessários para a quimiotaxinomia do gênero, do qual se tem poucos estudos.
A espécie Piranhea trifoliata é uma árvore bastante encontrada na América do Sul[17,18] e popularmente conhecida como Piranheira, pois seus frutos e sementes servem de alimentos para cardumes de piranhas[19]. É uma árvore grande de até 25 metros de altura e vive mais de 400 anos[19,20]. É frequentemente encontrada nas regiões de várzeas e igapós, e sua casca é usada como curativo para inflamações no útero em banhos de assento e para chás no tratamento de malária[19]. Na literatura foi encontrado apenas um estudo fitoquímico, realizado pelo nosso grupo de pesquisa, das folhas de P. trifoliata no qual foram isolados 6 triterpenos[21], não havendo relato de estudos sobre suas atividades biológicas.
Neste contexto, este trabalho teve como objetivo realizar o estudo químico dos extratos DCM e MeOH dos galhos de P. trifoliata e avaliar o seu potencial antimalárico.
Material e Métodos
Coleta e identificação do material vegetal
Os galhos foram coletados duas vezes. As duas coletas foram realizadas em Altamira, na Volta Grande do Xingu no estado do Pará, sendo a primeira coleta em novembro de 2008 e a segunda em agosto de 2009. As exsicatas foram catalogadas e registradas no herbário do Instituto Federal de Ciência e Tecnologia do Amazonas – IFAM, sob os números 10652 para a 1ª coleta e 10654 para a 2ª coleta. A coleta teve autorização do IBAMA número: 16970-1.
Obtenção dos extratos vegetais
Os galhos foram secos em estufa a 50 °C por aproximadamente dois dias, e posteriormente triturados em moinho de facas para o preparo dos extratos. O material seco foi extraído com solventes de polaridade crescente, diclorometano (DCM), metanol (MeOH) e água (H2O). Foram realizadas três extrações utilizando ultrassom por 20 minutos, a cada extração realizada. Após cada extração, o extrato obtido foi filtrado e seco, utilizando evaporador rotativo, sob pressão reduzida, em temperatura < 50 °C. Os extratos brutos DCM e MeOH das duas coletas foram comparados por CCDC e por serem distintos não foram reunidos. Os extratos aquosos não foram utilizados neste estudo e foram guardados em refrigeradores para futuros estudos.
Análise cromatográfica em camada delgada comparativa (CCDC)
Os extratos de P. trifoliata foram analisados por CCDC com o objetivo de averiguar a complexidade química dos extratos. Os extratos DCM e MeOH da 1ª e 2ª coleta foram submetidos a análise por CCDC e revelados com alguns reveladores químicos e físicos, para detecção das classes dos constituintes químicos presentes em cada extrato.
Após eluição as placas foram reveladas com luz UV (comprimento de onda de 254 e 365 nm) e, também, com alguns reagentes químicos, para detectar a presença de algumas classes químicas, tais como: Ce(SO4)2 para detecção de terpenos, anisaldeído para detecção de terpenos entre outras classes, FeCl3 para detecção de substâncias aromáticas, AlCl3 para confirmar a presença de flavonoides. Assim, consequentemente, foi possível estabelecer uma estratégia para a separação e purificação de suas substâncias.
Isolamento dos constituintes químicos dos galhos de P. trifoliata
O extrato DCM (5 g) da primeira coleta foi submetido a uma coluna filtrante (CCF) de sílica gel utilizando os solventes: DCM, acetato de etila (AcOEt) e MeOH. A fração 1-2 (3,5 g) foi refracionada em cromatografia em coluna aberta (CCA) de sílica gel utilizando como fase móvel misturas de solventes (HEX/DCM; DCM/AcOEt e AcOEt/MeOH). Das frações resultantes a fração 21 (45,7 mg), foi submetida a um novo fracionamento em CCA usando sílica gel como adsorvente e eluida com misturas dos solventes (HEX/AcOEt e AcOEt/MeOH), resultando na fração 13 (6,3 mg) denominada de substância 1.
O extrato MeOH (130,0 g) foi submetido a uma partição líquido-líquido, a qual permitiu a obtenção de três fases, desta a fase DCM (2,41 g) foi fracionada em CCA usando sílica gel como fase estacionária usando como fase móvel misturas dos solventes (HEX/DCM; DCM/AcOEt e AcOEt/MeOH). De fracionamentos sucessivos da fase DCM obteve-se as frações 31-32 (2,2 mg) denominada de substância 2, a fração 3 (1,0 mg) denominada de substância 3 e na fração 42-46 (9,4 mg) denominada de substância 4 e 5.
Métodos espectroscópicos
Os espectros de RMN de 1H e 13C foram obtidos em equipamento Bruker BioSpin AG, modelo Fourier 300 Ultrashield, 300 MHz para 1H e 75 MHz para 13C, as frações foram analisadas por RMN de 1H e de 13C mono e bidimensionais, utilizando na dissolução das amostras clorofórmio deuterado com TMS. Os deslocamentos químicos () foram expressos em partes por milhão (ppm) e as constantes de acoplamento em Hz.
Avaliação da atividade antimalárica
Os testes in vitro dos extratos DCM e MeOH foram realizados com hemácias infectadas por P. falciparum, clone W2, resistente a cloroquina, através do método LDH (lactato desidrogenase)[22]. As amostras foram solubilizadas com DMSO resultando uma solução estoque de cada amostra na concentração de 50 mg/mL. A cloroquina foi utilizada como antimalárico padrão e considerada muito ativa com valor de CI50 = 0,145 mg/mL.
A incubação, parasito-droga, foi realizada com 20 mL de cada diluição dos compostos testados colocados em microplacas de 96 poços, em triplicata, onde já se encontravam 180 mL da suspensão de hemácias infectadas (1% hematócrito, 2% de parasitemia), provenientes de um cultivo. Foram usados controles sem drogas, com hemácias infectadas (controle positivo) ou hemácias não infectadas (controle negativo).
Em seguida, as placas foram incubadas em atmosfera de 5% de CO2 a 37 ºC por 48 h, com amostras e controles. Após esse período as microplacas foram congeladas (-20 ºC no mínimo por 24 h), para promover a lise das hemácias.
O lisado celular foi transferido para placas de 96 poços, aos quais foram adicionados 100 µL de reagente Malstat e 25 µL de reagente NBT/PES. Após 1 h de incubação, a absorbância de cada poço das placas foi registrada em espectrofotômetro (540 nm).
Os percentuais de redução do crescimento dos parasitos foram calculados a partir da absorbância.
As amostras foram avaliadas em dois experimentos independentes. As amostras foram testadas em duas concentrações, 25 e 50 µg/mL, cada uma em triplicata, para a avaliação do percentual de redução da parasitemia. Aquelas que apresentaram percentual de redução de parasitemia igual ou maior que 50%, foram selecionadas para determinação das CL50, sendo realizados testes em 6 diferentes concentrações.
Os resultados foram avaliados no programa Origin 8.0 com determinação das curvas dose-resposta traçadas com ajuste sigmoidal. Foram determinadas as concentrações inibitórias do crescimento de 50% dos parasitos (CI50) em relação aos controles sem drogas.
Avaliação de citotoxicidade
Após a realização da avaliação da atividade antimalárica, amostras consideradas ativas no teste antimalárico, foram submetidas ao ensaio de citotoxicidade in vitro na linhagem celular HepG2 A16, derivada de um hepatoblastoma primário humano.
Primeiramente as células derivadas da linhagem celular HepG2 foram distribuídas em microplacas de 96 poços (4x105 células/100 µL por poço) e incubadas em estufa de CO2 à 37 °C por 24 h para a adesão das células à placa.
Em seguida, foram adicionados 100 µL de meio completo contendo diferentes concentrações dos extratos testados em triplicata. As placas foram incubadas por mais 24 h.
Ao final deste período, foram adicionados 18 µL/poço de uma solução brometo 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT), na concentração de 20 mg/mL. Após 1 h e 30 minutos a leitura foi realizada em espectrofotômetro a 492 nm.
A dose letal mínima que inibe em 50% o crescimento das células na presença dos extratos testes e de antimaláricos controles foi determinada em comparação com células cultivadas sem a presença de compostos, considerada 100% de crescimento.
Os resultados foram avaliados no programa Origin 8.0 com determinação das curvas dose-resposta traçadas com ajuste sigmoidal. Foram determinadas as concentrações citotóxicas que inibem em 50% o crescimento das células (CC50) em relação aos controles sem drogas.
Para as amostras consideradas ativas foi calculado o índice de seletividade que é dado pela razão entre o valor obtido de CC50 para células HepG2 e o valor de CI50 para P. falciparum.
Resultados e Discussões
Coleta do Material Vegetal e Obtenção dos Extratos
Foram coletados galhos (FIGURA 1) de duas coletas diferentes (TABELA 1). Foram obtidos seis extratos e os extratos aquosos foram guardados em refrigerador para estudos futuros. Dos 4 extratos resultantes estudados, foi observado que os metanólicos para as duas coletas foram os que apresentaram uma maior porcentagem de rendimento (TABELA 1), destacando-se principalmente a 1ª e a 2ª coleta com rendimentos acima de 5%, já os extratos diclorometânicos obtiveram rendimentos inferiores a 1%.

| Coleta | Solvente (L) | Material vegetal (Kg) | Massa extrato (g) | Rendimento (%) |
| 1 | DCM (6 L) | 4,0 | 24,11 | 0,60 |
| 1 | MeOH (6 L) | 4,0 | 206,19 | 5,15 |
| 2 | DCM (7,5 L) | 5,0 | 10,09 | 0,20 |
| 2 | MeOH (7,5 L) | 5,0 | 264,82 | 5,29 |
Análise cromatográfica em camada delgada comparativa (CCDC)
A análise em camada delgada comparativa (CCDC) dos extratos DCM da primeira e da segunda coleta indicaram a presença de terpenos, observados quando as placas foram reveladas com sulfato cérico, pois apresentaram uma coloração vermelha intensa. Observou-se também a presença de substâncias fluorescentes sob a luz UV em 365 nm, um indicativo da presença de substâncias aromáticas. Quando revelados com DPPH mostraram a presença de possíveis antioxidantes pela coloração amarelada. Não foi identificada a presença de alcaloides quando as placas foram reveladas com o Reagente de Dragendorff, pois não se verificaram manchas de coloração alaranjada.
Os extratos MeOH dos galhos apresentaram a presença de terpenos nos extratos da primeira e segunda coleta, quando as placas cromatográficas foram reveladas com sulfato cérico, pois apresentaram uma coloração vermelha intensa. Quando as placas cromatográficas foram reveladas com DPPH mostraram a presença de possíveis antioxidantes pela coloração amarelada. Também não foi identificada a presença de alcaloides quando as placas cromatográficas foram reveladas com o Reagente de Dragendorff.
Ao comparar as duas coletas é possível observar que há muita diferença entre as coletas realizadas, o que pode ter sido influenciado pela diferença de localidades e sazonalidade das coletas. Esses extratos mostraram-se ricos quimicamente revelando uma grande quantidade de possíveis substâncias a serem isoladas.
Substâncias Isoladas dos galhos de Piranhea trifoliata
A substância 1 (S-1) obtida do extrato DCM dos galhos da 2ª coleta, apresentou-se na forma de cristais brancos, e quando revelada com Ce(SO2)4 verificou-se a coloração vermelha, com Rf = 0,35, quando eluída com HEX/AcOEt 95:05.
O espectro de RMN de 1H da S-1, apresentou sinais na região de dH 0,73 a 1,26 ppm, sendo 7 simpletos em dH 0,73; 0,89; 0,96; 1,00; 1,01; 1,05; 1,18; e um dupleto em dH 0,87 (6,58 Hz), sendo estes oito sinais referentes a 8 metilas, sugerindo que se tratava de um triterpeno. Não foi observada a presença de ligações duplas na região de dH 5,0 e 6,0, indicativo de um esqueleto friedelano e sinais entre dH 1,3 e 2,5 referentes aos hidrogênios metilênicos e metínicos.
O espectro de RMN de 13C mostrou a presença de 30 sinais, sendo um sinal em δC 213,0 indicando a presença de uma carbonila. Também foi possível confirmar a ausência de sinais de ligação dupla nas regiões de δC 100 a 150. E em δC 6,8 observou-se o sinal referente a metila na posição C-23, característico do esqueleto friedelano.
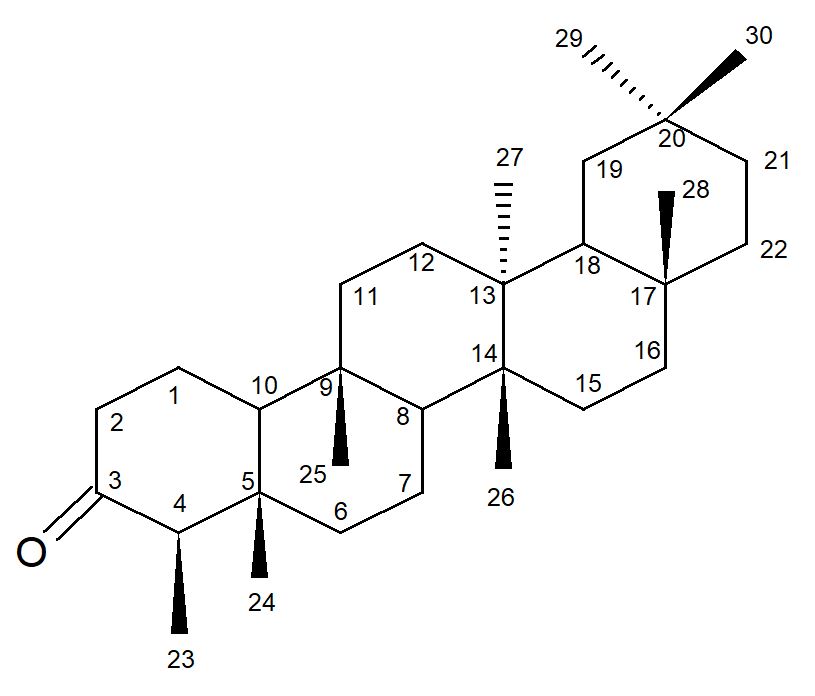
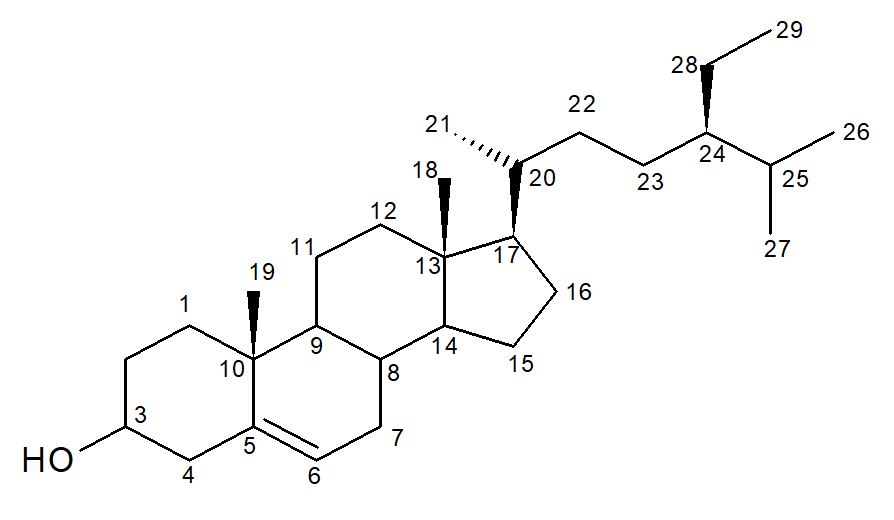
As análises dos dados dos espectros de RMN de 1H e 13C foram comparadas com dados da literatura[23] (TABELA 2), sendo assim possível confirmar a S-1 como sendo o triterpeno friedelan-3-ona (FIGURA 2).
| Posição | δC Observado | δC Literatura | Tipos de Carbono |
| 1 | 22,3 | 22,3 | CH2 |
| 2 | 41,5 | 41,5 | CH2 |
| 3 | 213,1 | 213,2 | C |
| 4 | 58,3 | 58,2 | CH |
| 5 | 42,1 | 42,1 | CH |
| 6 | 41,3 | 41,3 | CH |
| 7 | 18,3 | 18,2 | CH2 |
| 8 | 53,1 | 53,1 | CH2 |
| 9 | 37,5 | 37,4 | C |
| 10 | 59,3 | 59,4 | CH |
| 11 | 35,6 | 35,6 | CH2 |
| 12 | 30,5 | 30,5 | CH2 |
| 13 | 39,7 | 39,7 | C |
| 14 | 38,3 | 38,3 | C |
| 15 | 32,4 | 32,4 | CH2 |
| 16 | 36,0 | 36,0 | CH2 |
| 17 | 30,0 | 30,0 | C |
| 18 | 42,8 | 42,8 | CH |
| 19 | 35,3 | 35,3 | CH2 |
| 20 | 28,2 | 28,1 | C |
| 21 | 32,8 | 32,7 | CH2 |
| 22 | 39,3 | 39,2 | CH2 |
| 23 | 6,8 | 6,8 | CH3 |
| 24 | 14,7 | 14,6 | CH3 |
| 25 | 17,9 | 17,9 | CH3 |
| 26 | 20,3 | 20,2 | CH3 |
| 27 | 18,6 | 18,6 | CH3 |
| 28 | 32,1 | 32,1 | CH3 |
| 29 | 35,0 | 35,0 | CH3 |
| 30 | 31,8 | 31,8 | CH3 |
A substância friedelan-3-ona está sendo relatada pela primeira vez nos galhos de P. trifoliata, porém esta substância já foi isolada das folhas de P. trifoliata[21].
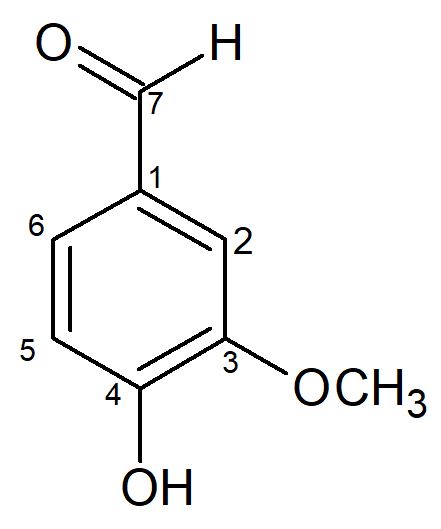
A substância 2 (S-2), obtida da fase DCM do extrato MeOH dos galhos da 2ª coleta, apresentou-se na forma de cristais brancos e Rf = 0,4, quando eluída com Hex/AcOEt 7:3. O seu espectro de RMN de 1H mostrou alguns sinais na região dos aromáticos em dH 7,05 (1H, d, J = 8,5 Hz, H-5), dH 7,44 (1H, dd, J = 8,5 e 1,8 Hz, H-6), dH 7,42 (1H, d, J = 1,8 Hz, H-2), mostrou singleto em dH 9,82 confirmando a presença do grupo aldeído, e em dH 3,97, relativo ao grupo metoxílico. Os dados foram comparados com a literatura[24] (TABELA 3) e foi possível confirmar S-2 como sendo a substância fenólica 3-metoxi-4-hidroxi-benzaldeído (FIGURA 3), sendo este o primeiro relato desta substância na família Picrodendraceae.
| Posição | Literatura | Observado | ||
| δH | δC | δH | δC | |
| 1 | - | 129,9 | - | - |
| 2 | (d) 7,38 | 108,7 | (s) 7,42 | - |
| 3 | - | 147,1 | - | - |
| 4 | - | 151,7 | - | - |
| 5 | (d) 7,0 | 114,4 | (d) 7,0 | - |
| 6 | (dd) 7,39 | 127,5 | (s) 7,44 | - |
| 7 | (s) 9,81 | 190,9 | (s) 9,82 | - |
| OH | - | - | - | - |
| OMe | (s) 3,96 | 56,1 | (s) 3,97 | - |
A substância 3 (S-3) obtida da fase DCM do extrato MeOH dos galhos da 2ª coleta, apresentou-se na forma de cristais brancos, e quando revelada com anisaldeído sulfúrico verificou-se a coloração lilás, com Rf = 0,77, quando eluída com Hex/DCM 9:1.
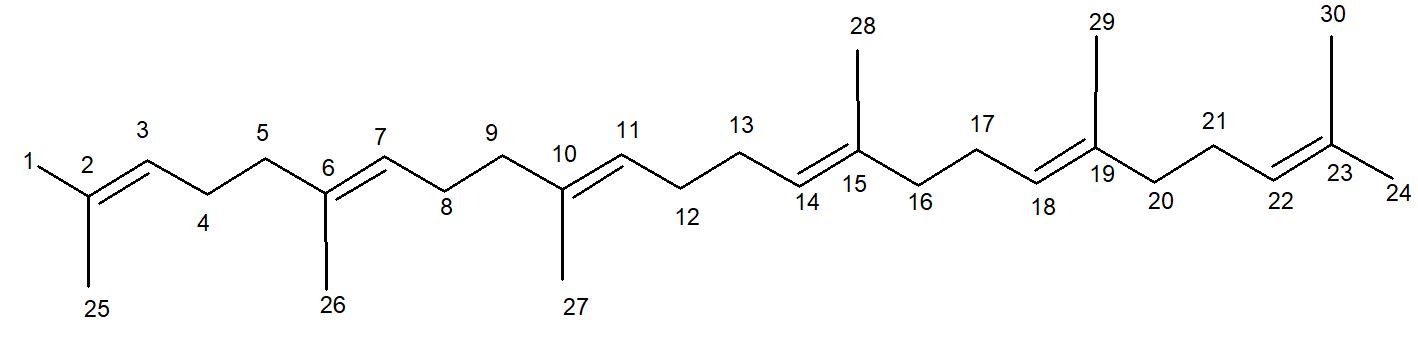
O espectro de RMN de 1H da S-3 apresentou sinais em δH1,68 (s, 6H) e 1,60 (s, 18H). Os hidrogênios em δH 1,68 atribuídos a grupos metílicos ligados a carbonos olefínicos nas posições C-1 e C-24 em δH 1,60 (s, 18H) atribuídos aos hidrogênios nas posições C-25, C-26, C-27, C-28, C-29 e C-30. Mostrou também sinais em δH 2,06 (m, 20H) indicando a presença de hidrogênios metilenos vizinhos a ligações duplas, e um multipleto em δH 5,14 (m, 6H) sugerindo a presença de hidrogênios olefínicos. Não foi possível realizar análises dos espectros de carbono, devido a quantidade de massa obtida ter sido pouca. Os dados do espectro de RMN de 1H foram comparadas com dados da literatura[25] (TABELA 4) e foi possível confirmar S-2 como sendo o triterpeno esqualeno (FIGURA 4).
| Hidrogênios | Literatura | Observados |
| δH | δH | |
| Hidrogênios metílicos ligados aos C-1 e C-24 | 1,80 | 1,68 (s) |
| Hidrogênios metílicos ligados aos C-25, C-26, C-27, C-28, C-29 e C-30 | 1,7 | 1,60 (s) |
| Hidrogênios metilênicos ligados aos C-4, C-5, C-8, C-9, C-12, C-13, C-16, C-17, C-20, C-21 | 2,06 | 2,0 (m) |
| Hidrogênios olefínicos ligados aos (C-3, C-7, C-11, C-14, C-18, C-22 | 5,0 | 5,14 (m) |
A substância esqualeno está sendo descrita pela primeira vez no gênero Piranhea. Esta substância é um triterpeno, classe química de metabólitos secundários, considerada marcadores químicos da família Picrodendraceae.
As substâncias 4 e 5 (S-4 e S-5) obtidas da fase DCM do extrato metanólico dos galhos da 2ª coleta, apresentaram-se na forma de cristais brancos e quando reveladas com Ce(SO4)2, verificou-se a coloração rosa com Rf = 0,33, quando eluída com DCM 100%.
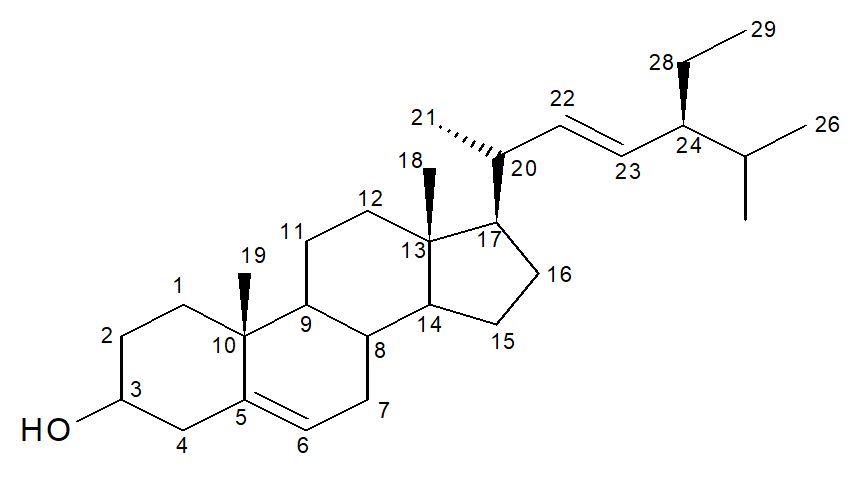
O espectro de RMN de 1H das substâncias 4 e 5 apresentou sinais nas regiões entre δH 0,69 a 2,33 ppm, referentes a hidrogênios de metílicos, metilênicos e metínicos, característicos de triterpenos e esteroides, com a presença do sinal em δH 0,69, um simpleto largo com integral para três hidrogênios, que é característico dos esteroides estigmasterol e β-sitosterol, foi possível inferir que as substâncias S-4 e S-5 eram esteroides. Apresentou também um multipleto em δH 3,52 atribuído a um hidrogênio ligado a carbono carbinólico, H-3 de ambos os esteroides. Em δH em 5,35 (2H, dl, J= 5,12 Hz), atribuído ao hidrogênio olefínico na posição H-6 de ambos os esteroides, e ainda dois duplos dupletos em δH 5,15 (1H,dd, J=15,18 e 8,38 Hz) e em δH 5,01 (1H, dd, J= 15,18 e 8,57 Hz), referentes aos hidrogênios H-22 e H-23 do esteroide estigmasterol. A comparação dos dados espectroscópicos obtidos com os descritos na literatura[21] (TABELA 5) permitiu confirmar que tratava-se da mistura constituída pelos esteroides estigmasterol (FIGURA 5) e β-sitosterol (FIGURA 6), respectivamente substâncias 4 e 5 esteroides comumente encontrados em plantas. As percentagens aproximadas dos dois constituintes na mistura foram calculadas com base na integração dos sinais correspondentes a H-6 (intensidade relativa: 1,70, relativo aos dois esteroides 4 e 5) e H-22 e H-23 (intensidade relativa: 2,09) relativo a dois prótons do molécula do estigmasterol, a metade de 2,09 (2,09/2=1,045) representou um próton da molécula do estigmasterol, subtraindo este valor de 1,70 obteve-se a intensidade de 0,655 correspondente a um hidrogênio da molécula de β-sitosterol as intensidades relativas 1,045 e 0,655 permitiram deduzir que a mistura contém 61,48% de estigmasterol e 38,52% de β-sitosterol.
| Hidrogênios | 4 - δH | 5 - δH | δH |
| Observado | Observado | Literatura | |
| Hidrogênios metílicos H-19 | (s) 0,69 | (s) 0,69 | (s) 0,69 |
| H-3 | (m) 3,52 | (m) 3,52 | (m) 3,54 |
| H-6 | (dl) 5,35 | (dl) 5,35 | (d) 5,37 |
| H-22 | (dd) 5,15 | - | (dd) 5,16 |
| H-23 | (dd) 5,01 | - | (dd) 5,01 |
Avaliação da atividade antimalárica
As amostras foram testadas em duas concentrações, 25 e 50 µg/mL. Aquelas que apresentaram percentual de redução de parasitemia igual ou maior que 50% nas duas concentrações testadas foram selecionadas para determinação das CI50.
Os extratos diclorometânicos da 1ª e 2ª coleta apresentaram um percentual de redução de parasitemia inferior a 50%, não sendo um percentual significativo e não tiveram a CI50 determinada, pois não obtiveram um resultado satisfatório. Já os extratos metanólicos da 1ª e 2ª coleta mostram resultados satisfatórios nos experimentos realizados. Os extratos das duas coletas apresentaram 100% de redução de parasitemia nas duas concentrações (100% em 25 µg/mL e 100% em 50 µg/mL) (TABELA 6). Os extratos foram então submetidos para a determinação da CL50.
| Extratos | % Redução | |
| 25 µg/mL | 50 µg/mL | |
| 1-G-DCM | 12 | 36 |
| 1-G-MeOH | 100 | 100 |
| 2-G-DCM | 25 | 36 |
| 2-G-MeOH | 100 | 100 |
| Cloroquina | 100 | 100 |
Os extratos metanólicos da 1ª e 2ª coletas foram considerados ativos (CI50 = 13,7 µg/mL para a 1ª coleta e de CI50 = 5,8 µg/mL para a 2ª coleta) (TABELA 7).
| Extratos | CI50 (µg/mL) | Classificação |
| Média | ||
| 1- G MeOH | 13,66 | Ativa |
| 2 G MeOH | 5,79 | Ativa |
| Cloroquina | 0,078 | Muito ativa |
Os estudos realizados com as fases dos extratos metanólicos da 1ª e 2ª coleta mostraram-se satisfatórios, com destaque para as fases DCM da 1ª e 2ª coleta com redução de parasitemia superior a 90% para as duas concentrações testadas para 1ª coleta (92% - 25 µg/mL e 93% - 50 µg/mL) (TABELA 8) e redução superior a 70% na concentração de 50 µg/mL para a 2ª coleta. Estas fases foram testadas para determinação da CL50. As demais fases testadas apresentaram um percentual de redução de parasitemia inferior a 50%, não sendo um percentual significativo e não tiveram a CI50 determinada, assim como os extratos.
| Extratos | %Redução | |
| 25 µg/mL | 50 µg/mL | |
| 1-G -MEOH-F-DCM | 92 | 93 |
| 1-G-MEOH-F-ACOET | 47 | 57 |
| 1-G-MEOH-F-H-MEOH | 39 | 49 |
| 2-G-MEOH-F-DCM | 36 | 71 |
| 2-G-MEOH-F-ACOET | 19 | 31 |
| 2-G-MEOH-F-H-MEOH | 10 | 47 |
| Cloroquina | 100 | 100 |
Das fases testadas destacaram-se principalmente as fases DCM da 1ª e 2ª coleta, onde foram obtidos valores de CI50 = 7,05 µg/mL para 1ª coleta sendo considerada ativa e CI50 = entre 25 e 50 µg/mL para a segunda coleta sendo considerada pouco ativa. Já a fase AcOEt da 1ª coleta foi considerada pouco ativa (CI50 = entre 25 e 50 µg/mL). E as demais fases foram consideradas inativas (TABELA 9).
| Amostras | CI50 (µg/mL) sobre P. falciparum (cepa W2) | Classificação |
| 1-G-MEOH-F-DCM | 7,05 ±1,08 | Ativa |
| 1-G-MEOH-F-ACOET | Entre 25 e 50 | Pouco ativa |
| 1-G-MEOH-F-H-MEOH | >50 | Inativa |
| 2-G-MEOH-F-DCM | Entre 25 e 50 | Pouco ativa |
| 2-G-MEOH-F-ACOET | >50 | Inativa |
| 2-G-MEOH-F-H-MEOH | >50 | Inativa |
| Cloroquina | 0,145 ± 0,02 | Muito ativa |
Avaliação de citotoxicidade
Após análise da CL50 obtida para a fase DCM da 1ª coleta, a mesma foi submetida ao teste de citotoxicidade e a concentração observada foi superior a 1000 µg/mL (TABELA 10).
| Amostra | CC50 (µg/mL) |
| 1-G-MEOH/F-DCM | >1000 |
| cloroquina | 167,04 ± 5,66 |
Após o teste de citotoxicidade foi realizado o cálculo do índice de seletividade dado pela razão entre o valor obtido de CL50 para células HepG2 e o valor de CI50 para P. falciparum.
A fase DCM da 1ª coleta apresentou índice maior que 10 (TABELA 11) e não foi considerada citotóxica, e assim foi possível inferir que esta fase é mais ativa nas células do parasita do que em células normais. Sendo este fator muito importante para estudos posteriores com P. trifoliata, pois quanto menor for a citoxicidade da fase DCM para linhagem de células normais maior será a especificidade de atuação sobre o parasita a ser combatido. Este elevado índice de seletividade para o P. falciparum incentiva a realização de estudos posteriores para o isolamento das substâncias para verificar se há a presença de uma única substância ou várias que sejam responsáveis pela atividade antimalárica.
| Amostra | CC50 (µg/mL) | CI50 (µg/mL) | IS* |
| 1-G-MEOH/F-DCM | >1000,0 | 7,05 | >141,84 |
| Cloroquina | 167,04 | 0,145 | 1152 |
| *IS – Índice de seletividade. | |||
Pela literatura consultada, pode-se relacionar parte da atividade antimalárica dos extratos desta espécie com a presença do triterpeno fridelina isolado dos galhos, pois há relato da atividade antimalárica desta substância frente ao Plasmodium falciparum na concentração de 7,70 µM[26]. No entanto, uma vez que o extrato DCM, que é rico em triterpenos desta classe, não apresentou atividade antimalárica, deve haver outras substâncias que sejam ativas sobre a cepa utilizada de P. falciparum. Indicando assim que Piranhea trifoliata é uma fonte de substâncias com atividade antimalárica ainda por conhecer.
Conclusão
O estudo fitoquímico dos galhos de P. trifoliata, permitiu o isolamento das substâncias: friedelna-3-ona, 3-metoxi-4-hidroxi-benzaldeído, esqualeno e a mistura dos esteroides estigmasterol e β-sitosterol. O esqualeno e a substância fenólica estão sendo descritos pela primeira vez na família Picrodendraceae.
As análises por cromatografia em camada delgada comparativa revelaram que os extratos DCM e MeOH de ambas as coletas são ricos em terpenoides.
Os extratos metanólicos dos galhos de P. trifoliata apresentaram um potencial antimalárico frente ao P. falciparum, sendo ainda necessários estudos químicos para o isolamento das substâncias ativas.
Os resultados obtidos neste trabalho contribuíram para o conhecimento biológico e químico tanto da espécie Piranhea trifoliata como de sua família Picrodendraceae. Sendo duas das substâncias isoladas relatadas pela primeira vez na família assim como as atividades biológicas para a espécie em estudo.
Agradecimentos
Os autores agradecem ao CNPq (projetos PPBio/CNPq, REPENSA/CNPq, CT-Agro/CNPq, CTAmazônia/CNPq e bolsas de produtividade de ABO e CVN) e CAPES (projeto Pro-Amazônia/CAPES) pelo apoio financeiro e pelas bolsas concedidas.
Referências
1. Valdés AF, Martínez JM, Lizama RS, Gaitén YG, Rodríguez DA. Payrol JA. In vitro antimalarial activity and cytotoxicity of some selected cuban medicinal plants. Rev Inst Med Trop São Paulo. 2010; 52(4): 197-201. ISSN 1678-9946. [CrossRef].
2. Lenta BN, Ngouela S, Boyom FF, Tantangmo F, Tchouya GRF, Tsamo E et al. Anti-plasmodial Activity of Some Constituents of the Root Bark of Harungana madagascariensis Lam. (Hypericaceae). Chem Pharmac Bul. 2007; 55(3): 464-467. ISSN 1347-5223. [CrossRef] [PubMed].
3. Hu YQ, Gao C, Zhang S, Xu L, Xu Z, Feng LS et al. Quinoline hybrids and their antiplasmodial and antimalarial activities. Eur J Med Chem. 2017; 20(139): 22-47. ISSN 0223-5234. [CrossRef] [PubMed].
4. Aditya NP, Vathsala PG, Vieira V, Murthy RSR, Souto EB. Advances in nanomedicines for malaria treatment. Adv Colloid Inter Sci. 2013; 1(17): 201-202. ISSN 0001-8686. [CrossRef] [PubMed].
5. World Health Organization - WHO, 2018. Global Priority List of Antibiotic-Resistant Bacteria to Guide Research, Discovery and Development of New Antibiotics. [Link].
6. Santos-Magalhaes NS, Mosqueira VCF. Nanotechnology applied to the treatment of malaria. Adv Drug Deliv Rev. 2010; 62(4-5): 560–575. ISSN 0169-409X. [CrossRef] [PubMed].
7. Soares IS; Rodrigues MM. Malaria vaccine: roadblocks and possible solutions. Braz J Med Biol Res. 1998; 31(3): 317-332. ISSN 0100-879X. [CrossRef].
8. Olliaro P. Mode of action and mechanisms resistance for antimalarical drug. Pharmacol Therap. 2001; 89(2): 207-219. ISSN 01637258. [CrossRef] [PubMed].
9. Guerin PJ, Olliaro P, Nosten F, Druilhe P, Laxminarayan R, Binka F et al. Malaria: current status of control, diagnosis, treatment, and a proposed agenda for research and development. The Lancet Infect Dis. 2002; 2(9): 564-573. ISSN 1476 3099. [CrossRef] [PubMed].
10. Rai M, Ingle AP, Paralikar P, Gupta I, Medici S, Santos CA. Recent advances in use of silver nanoparticles as antimalarial agentes. Inter J Pharmac. 2017; 526(1): 254-270. ISSN 0378-5173. [CrossRef].
11. Gomes AR, Ravenhall M, Benavente ED, Talman A, Sutherland C, Roper C et al. Genetic diversity of next generation antimalarial targets: A baseline for drug resistance surveillance programmes. Inter J Paras: Drugs Drug Resist. 2017; 7(2):174-180. ISSN 2211-3207. [CrossRef] [PubMed].
12. Saifi MA, Beg T, Harrath AM, Altayalan FSH, Al-Quraishy S. Antimalarial drugs: mode of action and status of resistance. Afr J Pharm Pharmacol. 2013; 7(5):148-156. ISSN 1996-0816. [CrossRef].
13. Hu YQ, Zhang S, Xu Z, Sheng Z, Liu ML, Feng LS. 4-Quinolone hybrids and their antibacterial activities. Eur J Med Chem. 2017; 141(1): 335-345. ISSN 0223-5234. [CrossRef] [PubMed].
14. Kaur K, Jain M, Kaur T, Jain T. Review antimalarials from nature. Bioorg Med Chem. 2009; 17(9): 3229-3256. ISSN 0968-0896. [CrossRef].
15. Castañeda PMR, Alma B, Garcia E, Chávez D, Mata R. Secondary metabolites from the stem bark Celaenodendron mexicanum. J Nat Prod. 1993; 56(9): 1575-1579. ISSN 0163-3864. [CrossRef].
16. Camacho MDR, Phillipson JD, Croft SL, Solis PN, Marshall SJ, Ghazanfar SA. Screening of plant extracts for antiprotozoal and cytotoxic activities. J Ethnopharmacol. 2003, 89(2-3): 185-191.ISSN:0378-8741 [CrossRef]
17. Secco R, Cordeiro I. Picrodendraceae: In: Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro-IPJBRJ. Disponível em: [Link]. Acesso em: 25 Mar. 2014.
18. Forzza RC. (Org). Catálogo de plantas e fungos do Brasil. v.1, Rio de Janeiro – Instituto de Pesquisas Jardim Botânico do Rio de Janeiro-IPJBRJ. 2010. ISBN: 978-85-88742-42-0.
19. Filho EMC. Plante as árvores do Xingu e Araguaia. São Paulo: Edição Revista e Ampliada, 2012. 260 p. ISBN: 978-85-8226-00 v5-0.
20. Worbes M, Klinger H, Revilla JD, Martins C. On dynamics, floristic subdivision and geographical distribution of varzea forest in Central Amazonia. J Veget Sci.1992; 3(4): 553-564. ISSN 1654-1103. [CrossRef].
21. Jeffreys MF, Nunez CV. Triterpenos das folhas de Piranhea trifoliata (Picrodendraceae). Acta Amaz. 2016; 46(2): 189-194. ISSN 1809-4392. [CrossRef].
22. Makler MT, Ries JM, Williams JA, Bancroft JE, Piper RC, Gibbins BL et al. Parasite lactate dehydrogenase as an assay for Plasmodium falciparum drug sensitivity. The Amer J Trop Med Hyg. 1993; 48(6): 739-741. ISSN 0002-9637. [CrossRef].
23. Mahato SB, Kundu AP. 13C NMR Spectra of Pentacyclic Triterpenoids Compilation and some Salient Features. Phytochemistry. 1994; 37(6): 1517-1575. ISSN 0031-9422. [CrossRef].
24. França VC, Vieira KVM, Lima EO, Barbosa-Filho JM, Cunha VL, Silva MS. Estudo fitoquímico das partes aéreas de Aristolocha birostris Ducht. (Aristolochiaceae). Rev Bras Farmacog. 2005; 15(4): 326- 330. ISSN 0102-696X. [CrossRef].
25. Cursino LMC, Mesquita ASS, Mesquita DWO, Fernandes CC, Pereira Junior OL, Amaral IL et al. Triterpenos das folhas de Minquartia guianensis Aubl. (Olacaceae). Acta Amaz. 2009; 39(1): 181-186. ISSN 1809-4392. [ CrossRef].
26. Lenta BN, Ngouela S, Boyom FF, Tantangmo F, Tchouya GRF, Tsamo E et al. Anti-plasmodial Activity of Some Constituents of the Root Bark of Harungana madagascariensis Lam. (Hypericaceae). Chem Pharm Bul. 2007; 55(3): 464-467. ISSN 1347-5223. [CrossRef] [PubMed].