Revisão
Curcuma longa L. (Zingiberaceae): desenvolvimento tecnológico para aplicação como agente terapêutico auxiliar no tratamento de pacientes portadores da Doença de Alzheimer
Curcuma longa L. (Zingiberaceae): technological development for application as an auxiliary therapeutic agent in the treatment of patients with Alzheimer's Disease
Resumo
A Doença de Alzheimer (DA) é uma enfermidade neurodegenerativa que provoca atrofia no cérebro, levando à demência em idosos; por não haver cura conhecida, os tratamentos medicamentosos disponíveis são relacionados a amenizar os sintomas. Entre os tratamentos alternativos, a Curcuma longa L. demonstrou propriedades anti-inflamatórias e antioxidantes, importantes para o processo de progressão da DA. Em contrapartida aos seus muitos benefícios, apresentou baixa biodisponibilidade nos estudos realizados. Na presente revisão objetivou-se buscar, na literatura, alternativas para melhorar a biodisponibilidade de C. longa para aplicação no tratamento da DA. Desta forma, foi realizada revisão bibliográfica em bases de dados científicas, utilizando estratégia de busca clara e inclusiva. Foram encontrados 93 artigos e, destes, selecionados 32. Dentre as alternativas encontradas, as formulações farmacêuticas ganharam destaque, com exemplos como nanopartículas, micelas e emulsões. As propriedades farmacológicas de C. longa e as muitas possibilidades de alterar sua biodisponibilidade justificam atribuir importância ao desenvolvimento de estudos direcionados ao uso destes compostos na terapia da DA. Portanto, espera-se que estes resultados possam incentivar o aprofundamento de pesquisas no sentido de desenvolvimento de fitoterápicos e/ou fitofármacos com base em C. longa e seus metabólitos para o tratamento auxiliar da doença de Alzheimer.
- Palavras-chave:
- Alzheimer.
- Cúrcuma.
- Tratamento.
- Curcumina.
- Neurodegenerativa.
- Biodisponibilidade.
Abstract
Alzheimer's disease (AD) is a neurodegenerative disorder that causes brain atrophy, leading to dementia in elderly. Considering that there is no known cure, the available drug treatments are related to alleviate the symptoms. Among the alternative treatments, Curcuma longa L. showed anti-inflammatory and antioxidant properties, important for the process of AD progression. Despite its benefits, it has been shown low bioavailability in studies performed. In the present review, we aimed to search the literature for alternatives to improve the bioavailability of C. longa for application in the treatment of Alzheimer's disease. Thus, a bibliographic review was performed in scientific databases, using a clear and inclusive search strategy. 93 articles were found and 32 were selected. Among the alternatives, pharmaceutical formulations showed featured, such as nanoparticles, micelles and emulsions. The pharmacological properties of C. longa and the many possibilities of altering its bioavailability, justify the importance to development of studies directed to use these compounds in AD therapy. Therefore, we hoped that these results may encourage further researches towards the development of C. longa-based phytotherapic and/or phytomedicines for the auxiliary treatment of Alzheimer's disease.
- Keywords:
- Alzheimer's.
- Turmeric.
- Treatment.
- Curcumin.
- Neurodegenerative.
- Bioavailability.
Introdução
A doença de Alzheimer (DA), ou mal de Alzheimer, é uma doença neurodegenerativa que provoca atrofia do cérebro, levando à demência em pacientes idosos [1]. Ela afeta a capacidade de realização das atividades diárias, envolvendo partes do cérebro relacionadas à memória e pensamento, evoluindo para problemas com linguagem e movimentos [2]. Tais manifestações estão relacionadas à região comprometida do cérebro, responsáveis pelas funções cognitivas e de comportamento [3].
Quanto à fisiopatologia da DA, tem-se que ela é caracterizada pelo acúmulo patológico de peptídeos beta-amiloides (A-β) e de proteína tau, levando à formação de emaranhados neurofibrilares e à perda de células neuronais [4]. Este aglomerado, conhecido como placas senis é decorrente de uma desordem no citoesqueleto neuronal, por hiperfosforilação da proteína tau [5]. A causa desta produção desordenada ainda não é totalmente elucidada, mas existem estudos que mostram algumas hipóteses para tal descontrole, incluindo fatores genéticos [6].
Por tratar-se de uma doença que ainda não tem cura, os tratamentos são direcionados a melhorarem a qualidade de vida dos pacientes [7]. Este tratamento pode ser dividido em 4 níveis: específico, objetivando reverter os processos que levam à morte neuronal; profilático, visando atrasar o início da demência; sintomático, que busca restaurar parcial ou temporariamente as capacidades cognitivas, funcionais e o comportamento; e, terapêutico complementar, relacionado a tratar as manifestações não-cognitivas, como depressão, psicose, distúrbios do sono e agressividade [5].
Os medicamentos utilizados incluem inibidores da colinesterase – donepezila, galantamina e rivastigma – para pacientes com demência de leve a moderada [7], e memantina para os estágios de moderado à grave [5]. Outros tratamentos têm sido estudados, porém a dificuldade de se encontrar algum que seja efetivo refere-se à diversidade de etiologias para a DA, deixando dúvidas sobre qual anormalidade seria o melhor alvo para esta terapia [8].
Tratamentos alternativos têm sido utilizados para compor esta terapia; alguns pacientes, por exemplo, utilizam o huperzina A – um alcaloide sesquiterpênico encontrado em Huperzia serrate, que apresenta forte efeito na inibição da acetilcolinesterase com mecanismo semelhante ao de outros medicamentos utilizados no tratamento da DA, demonstrando bem menos reações adversas [9]; porém não é regulamentado pela FDA, podendo, dessa forma, apresentar informações imprecisas em relação a sua potência [8].
Outra linha de estudo é o da utilização de extratos de plantas, tais como guaraná (Paullinia cupana), cumaru (Dipteryx odorata) [10] e cúrcuma (Curcuma longa) [11]. O destaque para Curcuma longa está associado, principalmente, pelas suas funções anti-inflamatória e antioxidante [12], mecanismos importantes no processo de progressão da DA. Em contrapartida aos seus muitos benefícios, apresentou baixa biodisponibilidade nos estudos realizados. Esta dificuldade pode ser hoje um dos motivos para o não ingresso da cúrcuma como tratamento coadjuvante de diversas patologias.
Buscando solucionar esta questão, vários pesquisadores se propuseram a desenvolver formulações com a cúrcuma e seus derivados. Na presente revisão, objetivou-se buscar na literatura, alternativas para melhorar a biodisponibilidade de C. longa para aplicação no tratamento auxiliar da DA. Desta forma, fornecendo uma base para estudos posteriores nesta área, tais como o desenvolvimento de fitofármacos e/ou fitoterápicos com base na C. longa para o tratamento da DA e outras doenças neurodegenerativas.
Material e Métodos
Para realizar a revisão bibliográfica acerca dos efeitos de Curcuma longa no tratamento da doença de Alzheimer, primeiramente, foi verificado o nome científico, sinônimos e nome popular para Curcuma longa nos sites Trópicos e Flora-do-Brasil. Os descritores foram verificados no MeSH e no DeCS para estabelecer a seguinte estratégia de busca: "Curcuma longa" OR "Amomum curcuma" OR "Curcuma domestica" OR "Stissera curcuma" AND "Alzheimer" OR "Alzheimer's Disease" OR "Dementia senile" OR "Demência Senil" AND bioavailability OR "biological availabilities" OR "biologic availability" OR "bioavailabilities" OR "physiologic availabilities".
A pesquisa foi realizada nos dias 15 e 16 de outubro de 2019, aplicando a estratégia de busca em bases de dados científicas, tais como PubMed, Cochrane Library e Scopus, totalizando 93 referências. Estas referências foram transferidas para o EndNote, um software de gerenciamento de referências, que encontrou e excluiu 22 duplicatas nesta primeira triagem.
Os critérios de inclusão foram: artigos que referiam atividades da Curcuma longa relacionadas à fisiopatologia da DA; artigos que propunham soluções para a melhora da biodisponibilidade de curcuma e seus derivados; ensaios clínicos que testaram formulações; revisões sistemáticas que relacionassem alterações tecnológicas na C. longa e seus derivados, revisões sistemáticas, metanálises e publicações oficiais de órgãos de saúde (ANVISA, Ministério da Saúde e FDA). Em contrapartida, os critérios de exclusão foram artigos sobre atividades da C. longa, não relacionadas à DA e doenças neurodegenerativas; ensaios clínicos utilizando a Curcuma longa em sua forma natural. Alguns artigos de revisão bibliográfica também foram incluídos para corroborar com a ideia final deste trabalho, além de estudos citados nos mesmos. Aplicando estes critérios, foram selecionadas 32 referências .
Resultados e Discussão
A cúrcuma (Curcuma longa L) é uma planta herbácea originária da Índia e do sudoeste da Ásia; também conhecida como turmérica, açafrão-da-terra ou açafrão-da-índia, pertence à mesma família do gengibre, a Zingiberaceae [13]. Sua composição química é bastante variada e apresenta, dentre as principais classes de compostos, os terpenos voláteis – que estão presentes no óleo essencial de diversas partes do vegetal; e os curcuminoides, que são a maior parte da fração não-volátil de sua composição. Estes últimos estão mais concentrados nos rizomas da planta, destacando-se a curcumina, desmetoxicurcumina e bisdesmetoxicurcumina (FIGURA 1), além de curcuminoides minoritários [14].
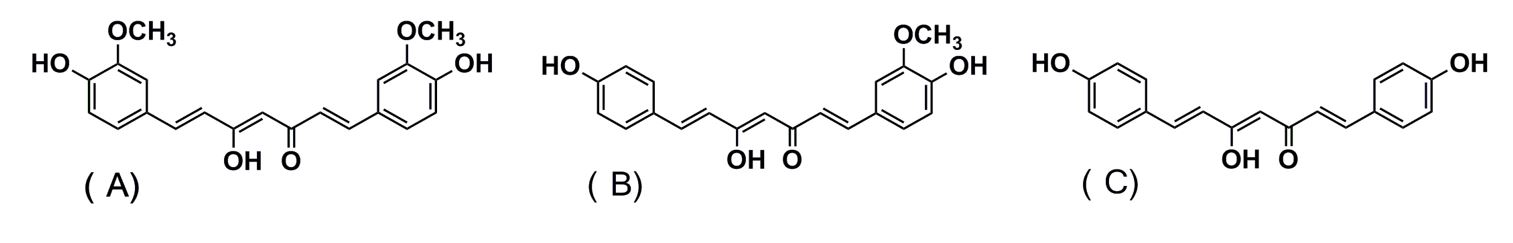
Dentre estes componentes, a curcumina foi a que mais apresentou estudos farmacológicos para diversas propriedades terapêuticas, tais como antioxidante, anti-inflamatória, antitumoral, cicatrizante e neuroprotetora [12]. Apesar disso, devido à sua baixa biodisponibilidade, sua aplicação no tratamento de algumas doenças é limitada. Isto se dá devido à curcumina ser uma molécula hidrofóbica [15], de rápido metabolismo in vivo [16]. Segundo Jadhav et al. [17], uma vez que o problema da biodisponibilidade seja resolvido (tanto da curcumina quanto de outros fitoquímicos), pacientes portadores de diversas doenças como Alzheimer e câncer terão alternativas viáveis de tratamento.
Visto que o maior obstáculo no desenvolvimento de fitofármacos e fitoterápicos baseados na C. longa e seus derivados é a baixa solubilidade em meio aquoso e, consequente, baixa biodisponibilidade – destes compostos, muitos estudos tem buscado alternativas que contornem este problema. Alguns exemplos de novas alternativas para melhorar a biodisponibilidade da curcumina são nanoencapsulação, micelação, complexação com fosfolipídios, conjugação de curcumina com açúcares [18,19]. Além disso, sendo consumida como alimento, a curcumina pode ter sua biodisponibilidade alterada por mecanismos como cozimento ou dissolução em óleo [20].
Formulações farmacêuticas e complexações
Uma importante linha de pesquisa, neste sentido, é o desenvolvimento de formulações lipossolúveis com base na C. longa, mantendo suas atividades farmacológicas. Assim sendo, Nahar et al. [21] testaram os efeitos anti-inflamatórios in vitro da curcumina em formulações lipídicas sólidas. Além da maior biodisponibilidade, este tratamento nas concentrações de 10 a 50μg reduziu significativamente os níveis de óxido nítrico e prostaglandinas-E2, enquanto que os níveis de interleucina-6 foram reduzidos à medida que a concentração aumentava [21].
Hagl et al. [22] realizaram 3 abordagens para examinar a biodisponibilidade da curcumina: in vitro (em células PC12), in vivo (em camundongos) e ex vivo (com mitocôndrias isoladas de cérebro de camundongo). Nas abordagens in vitro e ex vivo foi feita a comparação de efetividade entre a curcumina isolada (concentração = 0,1 μM) e as micelas de curcumina (10 μM); ainda que ambas as concentrações tenham sido capazes de diminuir o inchaço mitocondrial, as micelas demonstraram mais eficiência, devido a sua maior solubilidade em meio aquoso [22].
Uma revisão de patentes foi realizada, constatando o uso de uma mistura de curcuminoides como suplemento oral contra a DA e outras doenças neurodegenerativas. A mistura é composta majoritariamente (95%) pelos curcuminóides curcumina, demetoxicurcumina e bisdemetoxicurcumina, além do óleo essencial de cúrcuma. O óleo é adicionado como potencializador da ação biológica através do aumento da biodisponibilidade, por conferir lipofilicidade à mistura [23].
As nanopartículas de curcumina também mostraram resultados positivos em termos de maior biodisponibilidade em um estudo realizado por Massimino et al. [24]. Neste caso, as nanopartículas foram obtidas através de uma solução parte etanol parte clorofórmio, e não apresentaram alterações negativas na expressão de sua atividade biológica.
Outro padrão de nanopartículas são as de polibutilcianoacrilato (PBCA), um sistema de distribuição de drogas que promete alta eficácia, juntamente com outros polímeros [25]. Sabendo disso, Mulik et al. [26] desenvolveram nanopartículas PBCA carregadas com curcuminoides revestidas com polaxâmero 188, através do método de evaporação de solvente. Este método permite tanto uma liberação controlada do medicamento quanto fotoestabilização aos curcuminoides [26]. De acordo com Mhillaj et al. [27], os melhores modelos de complexação para a curcumina são os derivados de ácido poli láctico-co-glicólico (PLGA), nanopartículas lipídicas sólidas e N-trimetil-quitosana.
Zou et al. [28] estudaram a possibilidade de aumentar a biodisponibilidade da curcumina em pó através de uma emulsão de excipientes, simulando os fluidos intestinais. Essa abordagem melhora a biodisponibilidade oral da curcumina (e outros nutracêuticos) por ser ingerido com o alimento excipiente especialmente projetado em um conceito de alimento ou bebida com ingredientes capazes de aumentar a biodisponibilidade de drogas consumidas concomitantemente [29].
McClure et al. [30] testaram uma formulação de curcumina aerossol em ratos 5XFAD. Esse estudo demonstrou aumento da permeabilidade da barreira hematoencefálica para a curcumina, bem como sua eficácia na prevenção da DA, com notável melhora da função cognitiva. Ademais, não foram observados efeitos colaterais ou tóxicos no sistema respiratório dos animais [30].
Além das dispersões sólidas, também foi relatado o uso de veículos peptídicos e oligossacarídeos cíclicos para solubilizar drogas hidrofóbicas como a curcumina [31]. A conjugação enquanto modificação estrutural é uma alternativa promissora, como apresentada por Ghosh et al. [32] em sua revisão. Exemplos dessa conjugação seria o revestimento da curcumina com quitosana, encapsulamento em lipossomas e em ciclodextrina [32,33].
Segundo Wu et al. [34], coadministrar uma molécula principal com um agente modulador de glucoronidação ou inibidor da CYP450 pode aumentar a biodisponibilidade da primeira molécula no alvo. A piperina, produto isolado da pimenta preta (Piper nigrum) e um conhecido inibidor da glucoronidação hepática e intestinal, é uma alternativa eficaz neste caminho [35]. Em um estudo realizado com ratos e humanos saudáveis, a administração da curcumina com a piperina demonstrou aumentar em até 150% a biodisponibilidade da curcumina em ratos e 2000% no homem [36]. A dose utilizada foi de 2 g/kg de curcumina + 20 mg/kg de piperina para ratos; e 2 g de curcumina + 20 mg de piperina para humanos.
Modificações estruturais
Em relação a modificações estruturais, outra linha de estudo é o desenvolvimento de análogos da curcumina. Desta forma, obtêm-se compostos de perfil de segurança semelhante, com biodisponibilidade oral e atividades aumentadas [37]. As alterações realizadas nestes análogos foram listadas por Bairwa et al. [37] em sua revisão. Dentre elas estão o padrão de substituição aril da curcumina na estrutura de b-dicetona e bioconjugados de curcumina com aminoácidos (ácido glutâmico, glicina e valina). Estes conjugados apresentaram propriedades antibacterianas, antioxidantes e antifúngicas muito melhores, devido a melhor solubilidade e diminuição da taxa metabólica [37].
Ensaios clínicos
Quanto aos ensaios clínicos, seus resultados de eficácia são divergentes devido à baixa solubilidade em meio aquoso dos compostos curcuminoides, e consequente dificuldade de atravessar a barreira hematoencefálica [38,39]. No entanto, os que apresentam resultados favoráveis devem também à maior biodisponibilidade da via utilizada.
Foi realizado um estudo com pessoas saudáveis de 40 a 60 anos de idade onde a formulação lipídica de curcumina (80 mg/dia) demonstrou efeitos positivos nos participantes, tais como aumento da capacidade de eliminação de radicais livres; aumento das atividades da catalase plasmática e; redução das concentrações plasmáticas de peptídeo β-amiloide [40].
Outro estudo foi realizado, duplo cego, com controle de placebo, durante 6 meses, desta vez com 34 pacientes portadores de DA, selecionados de forma aleatória [41]. Neste estudo os pacientes foram divididos em 2 grupos, onde o primeiro recebeu 1 g de curcumina + 3 g de placebo, e o segundo recebeu 0 g de curcumina + 4 g de placebo, como doses diárias. Além disso, alguns pacientes preferiram utilizar a mistura em forma de pó, enquanto outros utilizaram na forma de cápsulas [41]. Foi constatada uma maior concentração de curcumina nos pacientes que utilizaram a cápsula, sugerindo uma maior absorção e menor metabolismo da curcumina nesta forma farmacêutica.
Por outro lado, Rainey-Smith et al. [42] realizaram um estudo clínico, também duplo cego, randomizado e com controle de placebo, e não obtiveram resultados significativos em relação à melhora cognitiva quando comparado ao grupo controle. Para mensurar a capacidade cognitiva dos participantes (160 indivíduos de 40 a 80 anos de idade) foi utilizado o teste MoCA – Avaliação Cognitiva de Montreal, que consiste num teste de perguntas e respostas, de duração média de 10 minutos e pontuação máxima de 30 pontos, aplicado para rastrear comprometimento cognitivo [43]. O estudo, conduzido por 12 meses, dividiu os participantes em 2 grupos e tratou um deles com 1500 mg/diários de curcuminoides em cápsula (88% de curcuminoides + 7% óleo volátil do rizoma da C. longa). Ao final dos 12 meses, a pontuação do teste MoCA foi equivalente para o grupo placebo e o grupo de tratamento [42].
Conclusão
Os trabalhos indicam grande potencial da C. longa e seus derivados no uso coadjuvante do tratamento da DA, bem como diversas possibilidades de melhoria da biodisponibilidade. Sua efetividade varia desde o combate à proliferação de espécies reativas de oxigênio (ROS) até a inibição enzimática, com resultados promissores em diversos estudos realizados.
Ainda que os ensaios clínicos aqui abordados tenham caráter inicial, as numerosas propriedades farmacológicas da C. longa justificam atribuir importância ao desenvolvimento de estudos direcionados a aplicação das técnicas de contornar a baixa solubilidade em água e ao uso destes compostos na terapia da DA. Dentre as alternativas apresentadas, a utilização de sistemas de entrega de fármacos, como as nanopartículas e os lipossomas, demonstraram eficácia no contorno da hidrofobicidade, além de permitirem expressão adequada de atividade farmacológica dos compostos de C. longa.
A partir do que foi aqui documentado, espera-se oferecer base e incentivo à comunidade científica a fim de aprofundar estudos, principalmente em ensaios clínicos e pré-clínicos, no sentido de desenvolvimento de fitoterápicos e/ou fitofármacos com base em C. longa e seus metabólitos, para o tratamento auxiliar da doença de Alzheimer.
Referências
1. Chang C-H, Lane H-Y, Lin C-H. Brain Stimulation in Alzheimer's Disease. Front Psychiatry. 2018; 9(201): 1-13. ISSN 1664-0640. [CrossRef] [PubMed].
2. Medlineplus: National Library of Medicine (EUA). Alzheimer's disease [revisado em 17 de agosto de 2016]. Disponível em: [Link]. Acesso em: 08 nov. 2019.
3. Cavalcanti JLS, Engelhardt E. Aspectos da fisiopatologia da doença de Alzheimer esporádica. Rev Bras Neurol. 2012; 48(4): 21-9. ISSN 2447-2573. Disponível em: [Link]. Acesso em: 10 nov. 2019.
4. Magalingam KB, Radhakrishnan A, Ping,NS, Haleagrahara N. Current Concepts of Neurodegenerative Mechanisms in Alzheimer's Disease. Biomed Res Int. 2018; 2018: 1-12. ISSN 2314-6141. [CrossRef] [PubMed].
5. Forlenza OV. Tratamento farmacológico da doença de Alzheimer. Rev Psiquitr Clin. 2005; 32(3): 137-48. ISSN 0101-6083. [CrossRef].
6. Smith MAC. Doença de Alzheimer. Rev Bras Psiquiatr. São Paulo, 1999; 21(2). ISSN 1809-452X. [CrossRef].
7. Brasil. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas – Doença de Alzheimer. Brasília, 2017. Disponível em: [Link]. Acesso em: 18 nov. 2019.
8. Weller J, Budson A. Current understanding of Alzheimer's disease diagnosis and treatment. F1000Res. 2018; 7: 1-9. ISSN 2046-1402. [CrossRef] [PubMed].
9. Bui TT, Nguyen TH. Natural product for the treatment of Alzheimer's disease. J Basic Clin Physiol Pharmacol. 2017; 28(5): 413-23. ISSN 0792-6855. [CrossRef] [PubMed].
10. Trevisan MTS, Macedo FVV. Seleção de plantas com atividade anticolinesterase para tratamento da Doença de Alzheimer. Quim Nova. 2003; 26(3): 301-4. ISSN 1678-7064. [CrossRef].
11. Martins DW, Lin HT, Paula CS. Extratos obtidos de plantas como fonte potencial para o tratamento da Doença de Alzheimer. Visão Acadêmica. Curitiba, 2016; 17(2): 16-39. ISSN 1518-8361. [CrossRef].
12. Scholze AFA. Biodisponibilidade da curcumina. Rev Bras Nutrição Clin Func. 2014; 14(60): 20-24. ISSN 21764522. Disponível em: [Link]. Acesso em: 20/11/2019.
13. Marchi JP et al. Curcuma longa L., o açafrão da terra, e seus benefícios medicinais. Arq Ciên Saúde UNIPAR. Umuarama, 2016; 20(3): 189-94. ISSN 1982-114X. [CrossRef].
14. Sueth-Santiago V, Mendes-Silva GP, Decoté-Ricardo D, Lima MEF. Curcumina, o pó dourado do açafrão-da-terra: introspecções sobre química e atividades biológicas. Quim Nova. 2015; 38(4): 538-52. ISSN 1678-7064. [CrossRef].
15. Del Prado-Audelo ML. Formulations of curcumin nanoparticles for brain diseases. Biomolecules. 2019; 9(2): 1-28. ISSN 2218-273X. [CrossRef] [PubMed].
16. Sun M. et al. Advances in nanotechnology-based delivery systems for curcumin. Nanomedicine. 2012; 7(7): 1085-100. ISSN 1748-6963. [CrossRef] [PubMed].
17. Jadhav NR, Nadaf SJ, Lohar DA, Ghagare PS, Powar TA. Phytochemicals formulated as nanoparticles: inventions, recent patents and future perspectives. Recent Pat Drug Delivery Formulation. 2017; 11(3): 173-86. ISSN 2212-4039. [CrossRef] [PubMed].
18. Chin D, Huebbe P, Pallauf K, Rimbach G. Neuroprotective Properties of Curcumin in Alzheimer's Disease – Merits and Limitations. Curr Med Chem. 2013; 20(32): 3955-85. ISSN 1875-533X. [CrossRef] [PubMed].
19. Venigalla M, Sonego S, Gyengesi E, Sharman MJ, Münch G. Novel promising therapeutics against chronic neuroinflammation and neurodegeneration in Alzheimer's disease. Neurochem Int. 2016; 95: 63-74. ISSN 0197-0186. [CrossRef] [PubMed].
20. Marczylo TH, Verschoyle RD, Cooke DN, Morazzoni P, Steward WP, Gescher AJ. Comparison of systemic availability of curcumin with that of curcumin formulated with phosphatidylcholine. Cancer Chemoth Pharm. 2007; 60(2): 171-7. ISSN 1432-0843. [CrossRef] [PubMed].
21. Nahar P, Slitt AL, Seeram NP. Anti-Inflammatory Effects of Novel Standardized Solid Lipid Curcumin Formulations. J Med Food. 2015; 18(7): 1-7. ISSN 1557-7600. [CrossRef] [PubMed].
22. Hagl S, Kocher A, Schiborr C, Kolesova N3, Frank J2, Eckert GP3. Curcumin micelles improve mitochondrial function in neuronal PC12 cells and brains of NMRI mice – impact on bioavailability. Neurochem Int. 2015; 89: 234-42. ISSN 0197-0186. [CrossRef] [PubMed].
23. Koynova R, Tenchov B. Natural Product Formulations for the Prevention and Treatment of Alzheimer's disease: A Patent Review. Recent Pat Drug Delivery Formulation. 2018; 12(1): 23-39. ISSN 2212-4039. [CrossRef] [PubMed].
24. Massimino LC, Faria HAM, Yoshioka SA. Curcumin bioactive nanosizing: Increase of bioavailability. Ind Crop Prod. 2017; 109: 493-7. ISSN 0926-6690. [CrossRef].
25. Kreuter J. Nanoparticle based drug delivery systems. J Control Rel. 1991; 16: 169-17. ISSN 1873-4995. [CrossRef].
26. Mulik R, Mahadik K, Paradkar A. Development of curcuminoids loaded poly(butyl) cyanoacrylate nanoparticles: Physicochemical characterization and stability study. Eur J Pharm Sci. 2009; 37: 3-4, 395-404. ISSN 1879-0720. [CrossRef] [PubMed].
27. Mhillaj E, Tarozzi A, Pruccoli L, Cuomo V, Trabace L, Mancuso C. Curcumin and heme oxygenase: Neuroprotection and beyond. Int J Mol Sci. 2019; 20(10). ISSN 1422-0067. [CrossRef] [ PubMed].
28. Zou L, Liu W, Liu C, Xiao H, Mcclements DJ. Utilizing food matrix effects to enhance nutraceutical bioavailability: increase of curcumin bioaccessibility using excipient emulsions. J Agric Food Chem. 2015; 63(7), 2052-62. ISSN 1520-5118. [CrossRef] [ PubMed].
29. Mcclements DJ, Xiao H. Excipient foods: designing food matrices that improve the oral bioavailability of pharmaceuticals and nutraceuticals. Food & Funct. 2014; 5(7): 1320-33. ISSN 2042-6496. [CrossRef] [ PubMed].
30. Mcclure R, Ong H, Janve V, Barton S, Zhu M, Li B. Aerosol delivery of curcumin reduced amyloid-β deposition and improved cognitive performance in a transgenic model of Alzheimer's disease. Retriev J Alzheimers Dis. 2017; 55(2): 797–811. ISSN 1875-8908. [CrossRef] [PubMed].
31. Schaffer M, Schaffer PM, Bar-Sela G. An update on Curcuma as a functional food in the control of cancer and inflammation. Curr Opin Clin Nutr Metab Care. 2015; 18(6): 605–11. ISSN 1363-1950. [CrossRef] [PubMed].
32. Ghosh S, Banerjee S, Sil PC. The beneficial role of curcumin on inflammation, diabetes and neurodegenerative disease: A recent update. Food Chem Toxicol. 2015; 83: 111–24. ISSN 0278-6915. [CrossRef] [PubMed].
33. Jadhav N, Powar T, Shinde S, Nadaf S. Herbal nanoparticles: A patent review. Asian J Pharm. 2014; 8(1): 58-69. ISSN 1998-409X. [CrossRef].
34. Wu B, Kulkarni K, Basu S, Zhang S, Hu M. First-pass metabolism via UDP-glucuronosyltransferase: a barrier to oral bioavailability of phenolics. J Pharm Sci. 2011; 100(9): 3655-81. ISSN 0022-3549. [CrossRef] [PubMed].
35. Aggarwal BB, Harikumar KB. Potential Therapeutic Effects of Curcumin, the Anti-inflammatory Agent, Against Neurodegenerative, Cardiovascular, Pulmonary, Metabolic, Autoimmune and Neoplastic Diseases. The Int J Biochem Cell Biol. 2009; 41(1): 40-59. ISSN 1878-5875. [CrossRef] [PubMed].
36. Shoba G, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas PS. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med. 1998; 64(4): 353-6. ISSN 0032-0943. [CrossRef] [PubMed].
37. Bairwa K, Grover J, Kania M, Jachak SM. ChemInform Abstract: Recent developments in chemistry and biology of curcumin analogues. RSC Advances. 2014; 45(34): 13946-78. ISSN 2046-2069. [CrossRef].
38. Chang D et al. Herbal Medicine for the Treatment of Vascular Dementia: An Overview of Scientific Evidence. Evid Based Complement Altern Med. 2016; 2016(7293626): 1-15. ISSN 1741-4288. [CrossRef] [PubMed].
39. D'Onofrio G et al. Phytochemicals in the Treatment of Alzheimer's Disease: A Systematic Review. Curr Drug Targets. 2017; 18(13): 1487-98. ISSN 1389-4501. [CrossRef] [PubMed].
40. Disilvestro RA, Joseph E, Zhao S, Bomser J. Diverse effects of a low dose supplement of lipidated curcumin in healthy middle aged people. Nutr J. 2012; 11(79): 1-8. ISSN 1475-2891. [CrossRef] [PubMed].
41. Baum L et al. Six-Month Randomized, Placebo-Controlled, Double-Blind, Pilot Clinical Trial of Curcumin in Patients With Alzheimer Disease. J Clin Psychopharm. 2008; 28(1): 110-3. ISSN 1533-712X. [CrossRef] [PubMed].
42. Rainey-Smith SR et al. Curcumin and cognition: a randomised, placebo-controlled, double-blind study of community-dwelling older adults. Br J Nutr. 2016; 115(12): 2106-13. ISSN 1475-2662. [CrossRef] [PubMed].
43. Guerreiro M. Testes de rastreio de defeito cognitivo e demência: uma perspectiva prática. Rev Port Med Geral Farm. 2010; 26(1): 46-53. ISSN 2182-5173. [CrossRef] .