REVISÃO
Proteases terapêuticas de planta: aspectos químicos, aplicações e formulações farmacêuticas
Plant therapeutic proteases: chemical aspects, applications and pharmaceutical formulation
Resumo
Proteases são enzimas que clivam as ligações peptídicas em proteínas e peptídeos. São encontradas em todos os organismos vivos e medeiam muitas funções cruciais. Estas enzimas têm sido utilizadas pelo homem desde a Antiguidade para diversos fins, como processamento de alimentos e tratamento de várias doenças. As plantas são fontes importantes de proteases com expressiva atividade e grande estabilidade térmica e na presença de diversos agentes químicos. Tais requisitos são essenciais para seu emprego farmacológico. Muitas, como a papaína, bromelina e ficina são comercializadas para tratar casos de insuficiências respiratórias e digestivas, infecções parasitárias e cicatrização de feridas. As proteases terapêuticas são muito específicas e eficientes, contudo, têm estruturas bastante complexas e sua manutenção requer condições muito específicas para garantir suas atividades biológicas/farmacológicas. Por isso, suas formulações são desenvolvidas para estabilizar sua estrutura/atividade, proteger contra degradação, melhorar sua farmacocinética, prolongar sua ação, reduzir seus efeitos tóxicos e direcioná-las para seu alvo terapêutico. A nanotecnologia possibilitou construir carreadores de fármacos, dentre eles nano/micropartículas poliméricas: hidrogéis, dendrímeros, lipossomas que são capazes de aumentar eficácia, aplicabilidade clínica e adesão do paciente ao tratamento. Tais polímeros biodegradáveis/biocompatíveis são promissores carreadores destas proteases terapêuticas de plantas.
- Palavras-chave:
- Enzimas de planta.
- Proteases terapêuticas.
- Imobilização.
- Formulação.
Abstract
Proteases are enzymes that cleave peptide bonds in proteins and peptides. Are found in all living organisms and mediate many crucial functions. These enzymes have been used by man since antiquity for various purposes such as food processing and treatment of various diseases. Plants are important sources of proteases with significant activity and high thermal stability and in the presence of various chemical agents. Such requirements are essential to your pharmacological employment. Many such as papain, bromelain and phytin are marketed to treat cases of respiratory and digestive insufficiency, parasitic infections and wound healing. Therapeutic proteases are very specific and efficient; however, they have very complex structures, and their maintenance requires very specific conditions to guarantee their biological / pharmacological activities. Therefore, their formulations are designed to stabilize their structure / activity, protect against degradation, improve their pharmacokinetics, prolong their action, reduce their toxic effects and direct them to their therapeutic target. Nanotechnology has made it possible to build drug carriers, including polymeric nano / microparticles: hydrogels, dendrimers, liposomes that are capable of increasing efficacy, clinical applicability and patient compliance. Such biodegradable / biocompatible polymers are promising carriers of these therapeutic plant proteases.
- Keywords:
- Plant enzymes.
- Therapeutic protease.
- Immobilization.
- Formulation.
Introdução
As plantas são utilizadas como medicamentos pelo homem desde os tempos mais remotos. Elas são fontes de uma grande variedade de moléculas biologicamente ativas cuja identificação química, bem como suas propriedades farmacológicas, têm sido bastante investigadas durante os últimos séculos[1]. Os produtos do metabolismo secundário vegetal são os mais estudados e os mais bem caracterizados, já que as plantas são conhecidas por expressarem uma grande variedade destes metabólitos em resposta às variações das condições ambientais e na defesa contra microrganismos, insetos e predadores de modo geral. Contudo, seus metabólitos primários, como as proteínas, são pouco estudados e seus potenciais farmacológicos ainda muito pouco explorados. As proteínas, especialmente nas leguminosas, cujos seus teores são bastante elevados, são contextualizadas no sentido de prover aminoácidos nas dietas humanas e animais[2]. As proteínas de plantas mais empregadas para fins farmacológicos são enzimas, particularmente as proteases ou enzimas proteolíticas.
As enzimas aumentam a velocidade das reações em sistemas biológicos, já que eles trabalham com condições amenas de pH, temperatura e força iônica. Ligam-se de modo específico ao substrato transformando-o em produto e são divididas em seis classes de acordo com o tipo de reações que catalisam: 1- Oxirredutases, 2- Transferases, 3- Hidrolases, 4- Liases, 5- Isomerases e 6- Ligases[3]. Geralmente as proteases catalisam reações de hidrólise de proteínas e peptídeos e regulam a fisiologia dos organismos. A seletividade e a eficácia das proteases têm tornado tais agentes terapêuticos referências no tratamento de inúmeras doenças[4]. Contudo, seus potenciais terapêuticos e aplicação clínica são, muitas vezes, afetados por problemas relacionados com via administração, instabilidade química, atividade farmacológica e dificuldade em atingir o alvo terapêutico. Nos últimos anos têm sido estudadas diversas formas de encapsular as proteases em transportadores adequados, de forma a serem administradas pela via oral, evitando os problemas anteriormente referidos e preservando assim o seu efeito terapêutico[5].
Entretanto, pesquisas recentes e avanços científicos no campo da nanotecnologia tornaram possível o desenvolvimento de sistemas nanoestruturados de liberação controlada, com o objetivo de modular a liberação de fármacos, no intervalo terapêutico, por tempo prolongado em dosagem única[6]. Este artigo tem por objetivo chamar a atenção de que as proteases de plantas são agentes terapêuticos em potencial, pois além de exibirem alta atividade proteolítica são muito estáveis e podem ser formuladas com mais facilidade não apenas como medicamentos tópicos.
Materiais e Métodos
Revisão de Literatura
As proteases
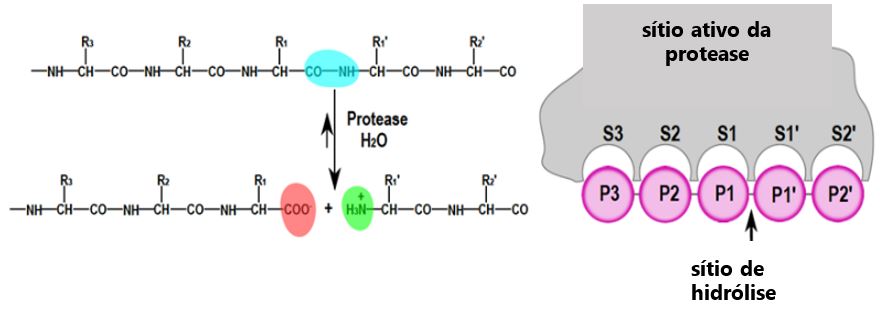
As proteases ou peptidases ou enzimas proteolíticas clivam irreversivelmente, geralmente por hidrólise, as ligações peptídicas em proteínas e em peptídeos, originando proteínas de menores massas moleculares, peptídeos de tamanhos variáveis ou aminoácidos livres (FIGURA 1). A especificidade reside no reconhecimento nos aminoácidos que flanqueiam a ligação peptídica a ser clivada[7]. Estão presentes em todos os organismos vivos, em todos os órgãos, organelas e produtos de secreção, e cerca de 2% do genoma de um organismo possui sequências que codificam para tais enzimas. Elas desempenham funções essenciais para manutenção da vida e morte, e estão envolvidas em muitos processos patológicos. Apresentam enorme diversidade química, cinética e estrutural para se adaptarem à grande variedade de funções e aos diversos ambientes onde catalisam[7- 9].
As proteases estão primariamente relacionadas com a digestão de proteínas e consequentemente na assimilação de aminoácidos para síntese de proteínas endógenas e de outros compostos orgânicos. Suas estruturas evoluíram e passaram a desempenhar outras funções como: coagulação, fibrinólise, remodelagem da matriz extracelular, ativação e inativação moléculas biologicamente ativas, enovelamento e degradação de proteínas mal formadas / danificadas por proteossomas, apoptose, necrose, degradação de antígenos, sistema complemento, dentre outras funções[8-10].
Nas plantas, as proteases são igualmente importantes para o crescimento, desenvolvimento, defesa contra patógenos, senescência, apoptose, formação do xilema, diferenciação dos tecidos e órgãos, maturação das sementes, mobilização das reservas de proteínas, germinação, divisão celular e reprodução, meiose, adaptação às condições ambientais, desenvolvimento de estômatos, biogênese de cloroplasto, processamento de proteínas, controle do metabolismo e outras funções[12-14].
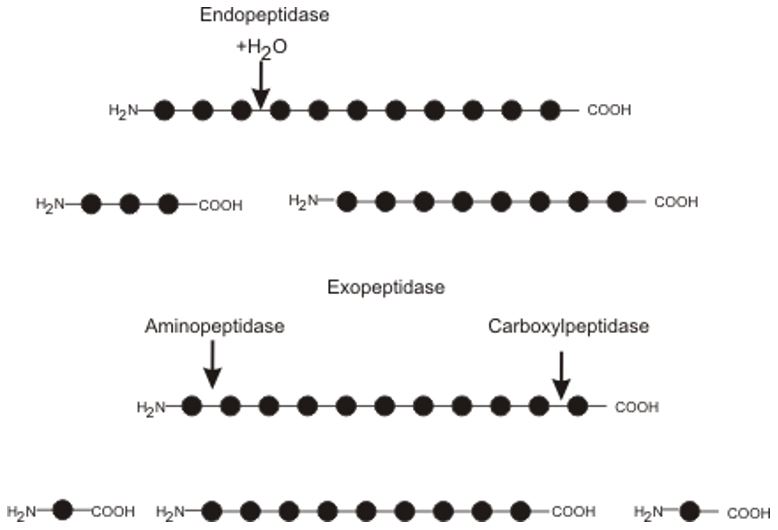
De acordo com a União Internacional de Bioquímica e Biologia Molecular (IUBMB), as proteases pertencem à classe 3, das hidrolases e subclasse 3.4, das peptídeo-hidrolases. As proteases são classificadas quanto ao local de clivagem em exopeptidases (EC 3.4.11-19), quando a quebra das ligações peptídicas ocorre nas extremidades N- ou C-terminal das cadeias polipeptídicas e em endopeptidases (EC 3.4. 21-99), quando ela ocorrer no interior da cadeia (FIGURA 2). Contudo, as proteases são principalmente classificadas de acordo com o aminoácido catalítico do sítio ativo envolvido na catálise. O grupo hidroxil das serino proteases (EC 3.4.21) e treonino proteases (EC 3.4. 25) e o grupo sulfidril das cisteíno proteases (EC 3.4.22) são agentes nucleofílicos, enquanto a água ativada é o agente nucleofílico nas aspártico proteases (EC 3.4.23), glutâmico proteases (EC 3.4.19) e metaloproteases (EC 3.4.24), que possuem respectivamente um resíduo do aminoácido catalítico serina, treonina, cisteína, ácido aspártico, ácido glutâmico e um íon para a catálise enzimática[15]. A quebra das ligações peptídicas é mediada classicamente por enzimas hidrolíticas. Contudo, ela pode também ocorrer por outros mecanismos como por liases carbono-nitrogênio (EC 4.3.2), denominadas de asparagino peptidases constituindo assim o sétimo grupo de proteases[16].
As proteases são ainda classificadas de acordo com a faixa de pH onde a atividade enzimática é máxima, já que a ionização dos aminoácidos catalíticos influencia na atividade enzimática. O valor de pH ótimo também sugere o compartimento celular no qual a protease catalisa. As aspártico-proteases atuam preferencialmente na faixa de pH ácido; as cisteíno em pHs levemente ácidos, as metaloproteases em pHs básicos. As serino-proteases atuam na faixa de pH neutro a alcalino (TABELA 1)[17]. O banco de dados MEROPSsobre proteases e inibidores de proteases, separa tais moléculas em clãs e famílias de acordo com a porcentagem de similaridade entre as sequências de aminoácidos (estrutura primária) e do sítio ativo das proteases (unidade peptidásica) ou o domínio inibidor de proteases. Cada família é identificada por uma letra que representa o tipo catalítico de cada protease: aspártico (A), cisteíno (C), glutâmico (G), metalo (M), asparagina (N), misto (P), serino (S), treonino (T) e desconhecido (U). A maior destas famílias é a das serino proteases com quase mil e quinhentas enzimas. De modo geral as famílias são subdivididas em subfamílias devido a uma divergência de ancestrais dentro da família como, por exemplo, entre a S1A e S1B (tipos de serino proteases)[18]. Estudos sobre o sequenciamento do genoma humano revelaram que mais de 2% dos nossos genes, cerca de 550, codificam para os diversos tipos de proteases e constituem uma das maiores famílias de enzimas [13,15].
| Tipo catalítico | Classificação | Aminoácidos catalíticos | Faixa de pH ótimo |
|---|---|---|---|
| Serino proteases | EC 3.4.21 | serina, aspartato e histidina | neutro a básico (7,0 a 11) |
| Cisteíno proteases | EC 3.4.22 | cisteína, aspartato e histidina | levemente ácido (5,5 a 6,5) |
| Aspártico proteases | EC 3.4.23 | aspartato e aspartato | Ácido (2,5 a 5,0) |
| Metalo proteases | EC 3.4.24 | metal | Básico (7,5 a 11) |
| Treonino peptidases | EC 3.4.25 | treonino, aspartato e histidina | neutro |
| Glutâmico peptidases | EC 3.4.19 | glutamato e glutamato | ácido |
| Asparagino peptidase | EC 4.3.2 | anparagina | neutro |
| Fonte: adaptado de Silva-López[17]. | |||
Como já mencionado, as proteases participam de diversos eventos fisiológicos, mas também estão envolvidas em processos patológicos como no mecanismo invasivo de tumores, no ciclo de infecção de grande número de vírus e micro-organismos patogênicos[19]. Portanto, a identificação e o entendimento sobre o mecanismo de ação das proteases possibilitam a utilização destas enzimas como valiosos alvos quimioterápicos para o desenvolvimento de novos compostos farmacêuticos, com maior especificidade e menor toxicidade. Além de serem alvos para desenvolvimento racional de medicamentos, elas também possuem importantes efeitos terapêuticos no tratamento de diversas patologias e condições[20].
As plantas expressam proteases de diferentes mecanismos catalíticos, cujas funções são, na maioria das vezes, ainda desconhecidas. Contudo, através dos estudos com plantas geneticamente modificadas pela mutação nos alelos, silenciamento ou super expressão de genes de determinadas proteases, tem sido possível identificar as funções na fisiologia do vegetal. Tais investigações também permitiram estudar as prováveis aplicações biotecnológicas e terapêuticas destas enzimas[13]. Sabe-se que as proteases de plantas apresentam importante estabilidade à variações de temperatura, pH e força iônica do meio, requisito essencial para sua aplicação em processos biotecnológicos[13,14].
Emprego biotecnológico das proteases
A biotecnologia refere-se ao conjunto de metodologias que se utilizam de organismos vivos ou partes deles para a produção ou modificação de produtos, bens ou serviços e para o aperfeiçoamento genético de micro-organismos, plantas e animais aplicados ao uso na indústria, na saúde e nos processos relativos ao meio ambiente. É uma área de conhecimento multidisciplinar que envolve várias áreas de conhecimento como: Bioquímica, Biologia Molecular, Microbiologia, Engenharia Química, dentre outras ciências. De acordo com o tipo de metodologia empregada a Biotecnologia está dividida em Tradicional e Moderna. Esta última se utiliza da tecnologia do DNA recombinante e outras técnicas de manipulação genética. Ambas são responsáveis pelo desenvolvimento de uma grande variedade de produtos, como alimentos, bebidas, enzimas, antibióticos, proteínas recombinantes e vacinas[21].
Antes mesmo de ter dominado as técnicas biotecnológicas, o homem já fazia uso da Biotecnologia de modo empírico ao empregar diferentes recursos naturais na modificação ou na formação de produtos, embora não houvesse ainda o conhecimento sobre a natureza e as propriedades das biomoléculas. Esses processos se davam principalmente pelo uso de enzimas, como na preparação de cervejas e vinhos, do esterco no amolecimento do couro, do coalho na confecção de queijo, do mamão papaya para amaciar carnes, dentre outros[22].
Resultados e Discussão
De acordo com um relatório publicado pela Allied Market Research, intitulado "Mercado de enzimas por tipo, origem, mecanismo de reação e aplicação: análise global de oportunidades e previsão do setor, de 2018-2024" o mercado global de enzimas foi estimado em 7.082 milhões de dólares em 2017, e está projetado para atingir US $ 10.519 milhões em 2024. Este crescimento resultará em ganhos associados com a produção de alimentos e bebidas, produtos de limpeza, ração animal, fármacos biológicos, processos biotecnológicos e uso em diagnóstico, pois além de serem muito específicas e rápidas, minimizam o custo e reduzem o tempo do processo de fabricação. Além disso, o uso de enzimas na indústria apresenta grandes vantagens, uma vez que são produtos atóxicos, com ações muito específicas e capazes de alterar as características de variados tipos de resíduos, contribuindo para reduzir a poluição ambiental.
No Brasil, o mercado de enzimas é ainda pequeno quando comparado ao mercado mundial[23,24]. No entanto, restrições relacionadas às propriedades químicas das enzimas, como baixa estabilidade, tem sido um fator desafiador para seus usos. Contudo, estas questões têm sido resolvidas e é observado aumento na utilização de tecnologias baseadas em enzimas, resultando em ganhos associados com a produção de alimentos e bebidas, produtos de limpeza, ração animal, fármacos e diagnóstico[24,25]. As proteases representam 50% das macromoléculas utilizadas em processos biotecnológicos[23].
É importante ressaltar que elas precisam ter atributos essenciais para que sejam empregadas, como a importante atividade proteolítica, especificidade, estabilidade em altas temperaturas e na presença de agentes químicos[19].
Proteases terapêuticas
As enzimas proteolíticas constituem uma classe crescente de medicamentos, tendo o FDA (Food and Drug Administration, Estados Unidos) aprovado mais de 30 proteases terapêuticas, além das novas proteases que ainda estão em fase de estudos clínicos. O conceito de enzima terapêutica tem mais de 50 anos, pois foram reportados usos destas enzimas na década de 1960 por De Duve como parte de terapias de reposição para deficiências genéticas[26].
Entende-se por proteases terapêuticas as enzimas proteolíticas empregadas no tratamento de enfermidades, procedimentos cirúrgicos, síntese de fármacos ou em diagnósticos de modo geral. Devem apresentar a pureza de acordo com a forma farmacêutica utilizada, especificidade, baixa antigenicidade (para evitar reações imunológicas) e estabilidade em condições fisiológicas. Existem relatos do uso destas enzimas no tratamento das mais diversas desordens, como hemofilias, hemorragias traumáticas, tromboses, infartos, isquemia cerebrovascular, adesão vitreomacular, fibrose cística, distrofia muscular, doenças celíacas, septicemias, insuficiências digestivas (pancreáticas e intestinais), desbridamento e cicatrização de feridas, cirurgias cardiovasculares e cateterismos[20,26].
Na geração de medicamentos injetáveis, a produção de proteínas heterólogas é a metodologia mais adequada e eficaz na produção de proteases terapêuticas, pois minimiza os riscos de contaminações e reações imunológicas em pacientes quando comparadas às proteases extraídas de tecidos humanos ou animais, que são geralmente utilizadas em medicamentos tópicos ou orais. A expressão heteróloga, embora tenha um custo de produção elevado, fornece maiores quantidades de proteínas em relação a sua extração de fontes naturais, cujo rendimento da purificação é, de modo geral, baixo e variável, uma vez que as enzimas encontram-se em baixas concentrações nos tecidos e líquidos biológicos[19]. Contudo, algumas proteases comerciais são obtidas em abundância de fontes naturais como, por exemplo, a colagenase (EC 3.4.24.3) de Clostridium hystoliticum que é secretada para o meio de cultura[27], a tripsina (EC 3.4.21.4) obtida de pâncreas bovino[28], a pepsina (EC 3.4.23.1) extraído de estômago de ruminantes e a papaína (EC 3.4.22.2) obtida do látex de Carica papaya[29].
O uso de proteases em medicamentos remonta ao final do século 19, quando preparações brutas de enzimas pancreáticas de origem suína eram empregadas no tratamento de desordens gastrointestinais. As primeiras preparações enzimáticas industrialmente produzidas e comercializadas atuavam como auxiliares digestivos.
Antes da Primeira Guerra Mundial, Takamine comercializou uma preparação enzimática denominada "Takadiastase", produzida pelo fungo Aspergillus oryzae, que ainda hoje é comercializado e contém hidrolases como proteases e amilases[30]. Estas enzimas foram usadas para tratar desordens da hemostasia, sendo obtidas de fontes naturais como a uroquinase, aprovada pelo FDA em 1978, e o Fator IX da coagulação, aprovado em 1986, provenientes de urina e do plasma humano, respectivamente. Posteriormente, outras proteases, como a trombina, obtida de plasma bovino, e as enzimas extraídas do pâncreas como a tripsina, a quimotripsina, a elastase e as carboxipeptidases foram aprovadas para comercialização e usadas com grande sucesso para diversos fins. Formulações tópicas de trombina são usadas em bandagens para acelerar a cicatrização de grandes feridas e queimaduras, enquanto cápsulas contendo as proteases pancreáticas são administradas por via oral para o tratamento de desordens digestivas ou patologias cuja digestão de proteínas está comprometida, como na fibrose cística. Em 1987, a primeira protease recombinante, o ativador de plasminogênio tecidual (tPa), foi aprovada para o tratamento das tromboses e comercializada como alteplase®, reteplase® e tenecteplase®[20].
Proteases terapêuticas de plantas
As plantas também expressam enzimas com significativa atividade proteolítica sobre diversos substratos de importância biológica, além de serem estáveis a altas temperaturas e na presença de agentes oxidantes, redutores, surfactantes, dentre outros, tais características são essenciais para seus empregos biotecnológicas como já reportado[31]. Por estes motivos, elas vêm sendo cada vez mais estudadas e caracterizadas quanto às suas estruturas, comportamento físico-químico e cinético, bem como sua aplicação (TABELA 2).
| Protease | Origem | Emprego |
|---|---|---|
| Actinidina | Kiwi (Actinidia Deliciosa) | Cura úlcera do pé diabético, aumento da digestão de proteínas e melhora a constipação/ suplemento dietético e amaciamento de carnes. |
| Bromelaína | Abacaxi (Ananas comosus) | Tratamento da trombose, artrites, feridas, cânceres, asma, bronquite, sinusite, má absorção de drogas, alivia dor, edema, doenças vasculares, cardíacas e inflamatórias/ Amaciamento de carnes, produção de pães, tecidos, alimentação, clareamento dentário. |
| Cardosina | Cardo (Cynara cardunculus) | Nenhum efeito terapêutico investigado/ Coagulação do leite e fabricação de queijo. |
| Cucumisina | Melão (Cucumis melo) | Tratamento de trombose/ Amaciamento de carnes, hidrólise do colágeno para obtenção da gelatina, coagulação do leite, síntese de dipeptídeos. |
| Ficina | Figo (Ficus genus) | Vermífugo / Síntese de peptídeos biologicamente ativos e clivagem de imunoglobulina G. |
| Oryzasina | Arroz (Oryza sativa) | Nenhum efeito terapêutico investigado/ Coagulação do leite. |
| Papaína | Mamão papaia (Carica papaya) | Tratamento de edemas, sinusite, distúrbios digestivos, remoção de cáries, cicatrização de queimaduras, infecções, câncer/ Detergente, tratamento de couro, amaciamento de carnes, síntese de peptídeos, produção de fragmentos de anticorpos, produção de bebidas, reduzir a alergia em alimentos. |
| Phytesina | Cevada (Hordeum vulgare) | Nenhum efeito terapêutico investigado/ Coagulação do leite. |
| Zingipaína | Gengibre (Zingiber officinale) | Agente antiproliferativo em modelo animal de câncer/ Nenhum uso biotecnológico investigado. |
Dentre suas principais ações, destaca-se: a ação imunomoduladora para o tratamento de alergias respiratórias[32], a capacidade de recuperação de tecidos lesados funcionando como agentes cicatrizantes, além do seu emprego para desordens digestivas e úlceras gástricas, tratamento de neoplasias e tumores, dentre outras doenças[33]. É inquestionável que essas proteases possuam um amplo potencial farmacológico, justificando assim o seu emprego em diferentes formulações farmacêuticas[34].
De modo geral, as proteases terapêuticas de plantas não são proteínas heterólogas, elas são obtidas diretamente dos órgãos vegetais de seus látex, e é possível extrair a proteína sem afetar a viabilidade da planta, ao menos que sejam obtidas das raízes. Suas preparações não têm potencial patogênico para animais, uma vez que não possuem agentes infecciosos que causam doenças em vertebrados. Além disso, seus processos de obtenção são relativamente simples, fáceis e de baixo custo. As proteases de plantas são amplamente utilizadas como enzimas terapêuticas no tratamento da cicatrização de feridas, distúrbios digestivos, doenças infecciosas, além de participarem em vários processos da indústria alimentar, tais como no amaciamento de carnes e coagulação do leite para produção de queijos e outros derivados[35]. As proteases de plantas mais empregadas no tratamento de doenças ou condições são: papaína, bromelaína e ficina respectivamente obtidas do mamão papaia, do abacaxi e do figo. Neste trabalho serão abordados alguns aspectos bioquímicos e farmacológicos de cada uma delas.
Papaína
A papaína é uma cisteíno protease (EC 3.4.22.2) extraída principalmente do látex de Carica papaya (mamão papaia) e em Vasconcellea cundinamarcensis (mamão de açúcar) pode ser encontrada em várias partes da planta. Caracteriza-se por ser uma endopeptidase, mas apresenta também atividades amidásica e esterásica, e exibe uma especificidade primária (P1) para aminoácidos volumosos, hidrofóbicos e aromáticos. É uma enzima de cadeia polipeptídica única com 212 aminoácidos e massa molecular de 23,406 kDa[36]. Sua atividade está relacionada com a maturação dos frutos: quanto mais verdes, maior atividade. Foi a segunda proteína a ser cristalizada (1968) e a primeira cisteíno protease com estrutura tridimensional elucidada (1984). A papaína é um modelo da família cisteíno protease do tipo papaína, auxiliando no entendimento do mecanismo de ação e da estrutura das cisteíno proteases[37]. Pertence à superfamília da papaína e à subfamília C1A de acordo com banco de dados MEROPS[38].
A papaína é estável em altas temperaturas, na presença de solventes orgânicos ou agentes desnaturantes. Tem atividade máxima em pH 6,0-7,0 e à 60°C. Ela possui muitos usos medicinais: tratamento de edemas, sinusites, síndrome do intestino gotejante, intolerância ao glúten, hipocloridria e outros distúrbios digestivos, bem como na remoção de cáries[39]. Além disso, a papaína tem atividade antibacteriana contra Bacillus subtilis, Enterobacter cloacae, Escherichia coli, Listeria monocytogenes, Salmonella typhimurium, Staphylococcus aureus e Proteus vulgari[40]. A ação antihelmíntica foi observada in vitro e in vivo contra Ascaris suum, Haemonchus contortus, Heligmosomoides polygyrus, Trichuris muris, Protospirura muricola e Strongyloides venezuelensis[41]. Já a atividade antifúngica foi demonstrada em relação a Aspergillus niger, Candida albicans, Mucor spp. e Rhizopus spp., pela possível clivagem do conteúdo de glicoproteínas na membrana celular[42]. Esta protease apresentou efeito anti-angiogênico, antitumoral, impedindo a proliferação, invasão e migração tumoral, bem como induziu apoptose em linhagens celulares de tumores humanos[43]. A papaína também é usada no debridamento tecidual para estimular a cicatrização de úlceras por pressão, por diabetes, por hanseníase, síndrome de Fournier e outras lesões, pois hidrolisa os tecidos necróticos, auxiliando na união das bordas da ferida e na regeneração tecidual. Além disso, estimula a produção de citocinas que reparam as células e diminuem o crescimento de micro-organismos[44].
Na planta a papaína leva à coagulação do látex, formando uma barreira física que constitui um passo primário no mecanismo de defesa[45]. Embora seja a cisteíno protease mais estudada, não é muito explorada como protease terapêutica. Existem poucos estudos sobre suas aplicações terapêuticas e nenhum relato em relação aos dados toxicológicos, embora forneça um modelo de estudo para cisteíno proteases semelhantes, que são agentes terapêuticos empregados no tratamento de muitas doenças[46].
Bromelaína
A bromelaína é um extrato aquoso rico em cisteíno proteases obtidas de caules e frutos de plantas da família Bromeliaceae, o qual o abacaxi (Ananas comosus, A. sativus, Bromelia ananas), é a espécie mais estudada. Neste extrato existem componentes não proteolíticos, como escarases, glicosidases, peroxidases, celulases, carboidratos, inibidores de protease e dentre outros, e pelo menos quatro proteases glicosiladas com massas moleculares entre 20 e 31 kDa que pertencem à superfamília da papaína: bromelina do caule (EC 3.4.22.32), comosaína e bromelina do fruto (EC 3.4.22.33) e ananaína (EC 3.4.22.31). Estas enzimas juntas têm a atividade proteolítica bromelaína e apresentam expressiva estabilidade a altas temperaturas. A sequência de aminoácidos da bromelina tem uma estreita semelhança com a da papaína e é preparada a partir de suco de abacaxi por centrifugação, ultrafiltração e liofilização que produz um pó amarelado. Tem sido empregado em muitos tipos de indústrias, como alimentos, bebidas, amaciamento de carnes, cosméticos, têxteis e farmacêuticos[47].
O abacaxi (conhecido quimicamente desde 1876) é usado como planta medicinal em várias culturas e suas propriedades medicinais são atribuídas à bromelaína. Devido à composição complexa, interage com uma grande variedade de moléculas e é responsável por uma diversidade de propriedades farmacológicas. Portanto, tem sido utilizado para o tratamento de doenças e condições como: artrite reumatoide, tromboflebite, feridas, cancro, angina, bronquite, sinusite, osteoartrite, traumas cirúrgicos, pielonefrite e para melhorar a absorção de certos fármacos. Em todos os casos, esse extrato alivia significativamente a dor, o edema e diminui o tempo de cicatrização comparado com tratamentos convencionais. A bromelaína reduz o risco de trombose, embolias e distúrbios vasculares e cardíacos[48]. Tais efeitos se deve a à inibição da ciclooxigenase-2 (COX-2), que reduz o nível de prostaglandina E2 (PGE2) e tromboxano A2, e aumenta a prostaciclina, que inibe a agregação de plaquetas e aumenta a atividade fibrinolítica, impedindo a formação de coágulos. A síntese de bradicinina em um sítio inflamatório é reduzida, e a formação de fibrina é limitada, minimizando assim a formação de coágulos e bloqueios dos vasos sangüíneos[49].
As infecções intestinais por Vibrio cholera e E. coli, cujas enterotoxinas provocam diarreia aguda, são afetadas pelo tratamento oral com bromelaína, pois ela degrada o receptor de adesão das bactérias à mucosa intestinal[50]. Estudos in vitro sugerem que a bromelaína tem atividade anti-helmíntica contra os nematoides gastrointestinais Trichuris muris e Heligmosomoides polygyrus, e antifúngica, estimulando a fagocitose e a morte de Candida albicans[48].
A bromelaína interfere na transformação celular, proliferação, angiogênese, invasão e metástase de cânceres. A PGE2 estimula a angiogênese e a progressão tumoral e como ela inibe a atividade da COX-2, diminui assim os níveis de PGE2 em linhagens de células de cânceres humano e murino[49].
Como já mencionado a bromelina diminui os mediadores inflamatórios e é um agente anti-inflamatório em várias condições. Ela atenua o quadro de asma em murinos, que é semelhante em humanos, pois reduzindo o número de leucócitos, eosinófilos e infiltrados celulares no pulmão em comparação ao grupo controle[51]. Este extrato é usado como terapia adjuvante no tratamento de doenças inflamatórias e autoimunes, como artrite reumatoide e osteoartrite, pois modula moléculas de adesão superficiais em células T, macrófagos e induz a secreção de IL-1β, IL-6 TNF-α. Além disso, possui propriedades analgésicas, uma vez que diminui os níveis de mediadores da dor como PGE2 e bradicinina[52].
O desbridamento é a remoção de tecidos mortos, infectados, senescentes e/ou desvitalizados de uma lesão, pois eles interferem na cicatrização. Este procedimento transforma uma ferida crônica em uma aguda e reduz a carga bacteriana. As bromelinas degradam tecido necrosado, regulam a maturação e multiplicação celular, síntese de colágeno e remoção de fibrina perivascular. Também hidrolisam colágeno, elastina, laminina, fibronectina e outros componentes danificados da matriz extracelular, liberando fatores de crescimento e angiogênicos sequestrados nessa matriz, ativando quimiocinas e citocinas. O desbridamento com bromelaína acelera a recuperação da perfusão sanguínea, melhora a inflamação, aumenta a quimiotaxia de fibroblastos e células musculares lisas e é mais eficiente que o desbridamento cirúrgico. Neste último, a incisão é dolorosa, não seletiva, expõe pacientes à anestesia, sangramentos e infecções. O desbridamento enzimático reduz o tempo de cicatrização de feridas, a morbidade e a mortalidade de pacientes severamente queimados. A bromelina tem toxicidade muito baixa, não é carcinogênica ou teratogênica[34].
Ficina
O gênero Ficus pertence à família Moraceae e a característica comum a todas as espécies é a presença de látex nas células laticíferas. O látex é um líquido complexo e pegajoso, de aspecto leitoso, excretado em resposta a lesões para proteger a planta da invasão de patógenos, como mencionado para a papaína. As frações proteolíticas dos látex de Ficus contêm predominantemente cisteíno proteases, mas também há serino e aspárticos proteases. O látex da figueira, Ficus carica, possui grande atividade de proteases, conhecidas como ficina (EC 3.4.22.3). Ela apresenta seis isoformas A, B, C, D1, D2 e E que pertencem as cisteíno proteases da família da papaína (família C1, clã CA). São proteínas glicosiladas de cadeia única com massas moleculares de cerca de 24 kDa[53].
A ficina pode ser empregada em muitas áreas da indústria alimentícia, como no amaciamento de carnes, hidrólise de colágeno para obtenção de gelatina e coagulação do leite. É usada como biocatalisador para síntese de dipéptidos. O látex de algumas espécies de Ficus tem sido tradicionalmente usado como vermífugo nas Américas Central e do Sul. Cápsulas contendo látex de F. glabrata digere vermes intestinais vivos. A atividade anti-helmíntica do látex de F. insipida Willd e F. carica foi reportada em camundongos naturalmente infectados com Syphacia obvelata, Aspiculuris tetraptera e Vampirolepis nana. Seu único uso farmacológico conhecido é matar vermes intestinais. Entretanto, nenhum ensaio clínico e toxicológico referente à ficina foi realizado[54]. Foi também reportada intensa atividade colagenolítica e quitinolítica, esta última conferindo à planta resistência contra fungos e insetos[55].
Mediante as propriedades biológicas das proteases de plantas descritas acima, bem como de outras enzimas farmacologicamente ativas, é possível lançar mão de estratégias para garantir seus usos terapêuticos através de formulações que mantenham as suas estruturas e consequentemente suas atividades.
Formulação farmacêuticas de proteases
As formulações farmacêuticas têm por finalidade garantir a estabilidade, solubilidade e as atividades biológica e farmacológica de um medicamento[56]. Historicamente, os primeiros medicamentos datam de farmacêuticos como Galeno (129-199 D.C.), que procuravam descobrir e utilizar medicamentos naturais na sua forma pura. Suas descrições incluem várias substâncias de origem natural, bem como fórmulas e métodos de manipulação, propondo preparações de substâncias vegetais pela mistura ou pela fusão dos componentes individuais.
Em 1928, a partir da segunda guerra mundial, Alexander Fleming marcou a história da Humanidade com a descoberta da penicilina, um importante antibiótico capaz de salvar muitas vidas[57,58]. Mas foi com o desenvolvimento da tecnologia do DNA recombinante, nos anos de 1980, que houve um aumento no número de novas moléculas de origem biotecnológica, com alto potencial terapêutico, como proteínas recombinantes, anticorpos monoclonais e ácidos nucléicos[59].
O emprego das enzimas proteolíticas como moléculas terapêuticas é de grande importância para o tratamento de várias doenças devido as suas altas especificidade e atividade. Portanto, são necessárias concentrações muito menores do que as dos fármacos sintéticos de baixo peso molecular para realizar o mesmo efeito farmacológico, além disso causam menos efeitos adversos. Mesmo com os avanços biotecnológicos, o uso de proteases como fármacos ainda constitui um grande desafio, porque elas possuem estruturas bastante complexas e instáveis, elevadas massas moleculares e baixa permeabilidade nas membranas biológicas das células alvo[60]. Com estas características, o fármaco biológico apresenta dificuldades no transporte, na liberação do princípio ativo no organismo, como também na perda da atividade que depende diretamente da manutenção da sua estrutura. Além das limitações encontradas na absorção, eles geralmente apresentam curta meia-vida no organismo, por conta da degradação enzimática no local de administração ou durante o seu percurso para o local de ação[61,62].
Os métodos convencionais de administração são desenvolvidos para liberar rapidamente moléculas biologicamente ativas com potencial terapêutico. Geralmente são empregados sistemas diluentes hidrossolúveis com o intuito de favorecer a solubilidade do fármaco. Contudo, manter os níveis de concentração plasmática dentro da faixa terapêutica ainda é um dos maiores desafios[63].
As proteases terapêuticas são geralmente administradas na forma de soluções aquosas ou suspensões pela via parenteral (subcutânea ou intravenosa), pois esta via de administração proporciona maior biodisponibilidade[64,65]. A via parenteral apresenta algumas desvantagens que incluem o risco de contaminação, a dor e o desconforto para o paciente durante a aplicação, necessidade de preparações estéreis e dificuldades para a autoadministração. As limitações deste tipo de administração medicamentosa, levaram à investigação de várias rotas alternativas para o fornecimento de medicamentos biológicos, incluindo pulmonar, nasal, oral, transdérmica, vaginal, retal e ocular, que foram exploradas para aumentar a adesão do paciente ao tratamento. A maioria das pesquisas que estudou a via de administração pulmonar prepararam formulações de aerossóis que foram muito eficazes para o tratamento de inflamações respiratórias e de outros distúrbios pulmonares[66]. Esta via se torna uma possibilidade para liberação sistêmica e não invasiva de proteases[67].
Uma outra rota terapêutica é a administração transdérmica, que se utilizou de adesivos como uma alternativa indolor às injeções, contudo ainda é pouco utilizada e veicula medicamentos hidrofóbicos e de baixa massa molecular, que não é o caso das enzimas[68]. A administração oral de medicamentos é uma via de tratamento mais fácil, barata e de melhor aceitação do paciente. Porém, para a formulação oral de proteases terapêuticas é muito limitada, devido a rápida degradação destas enzimas pelas condições drásticas do trato gastrointestinal, que apresenta grande variação do pH e proteases digestivas. Além disso, estas proteases terapêuticas não conseguem permear da membrana intestinal, visto que é necessário um receptor acoplado a um transportador ou carreador para absorvê-las[69]. Cada uma destas rotas oferece vantagens e limitações por conta das barreiras biológicas e das propriedades físico-químicas destes fármacos de natureza proteica e na sua entrega até seus alvos terapêuticos. No entanto, as formulações têm sido desenvolvidas para superar ou minimizar tais limitações.
Algumas destas estratégias de formulação podem ser utilizadas para aumentar a biodisponibilidade destes fármacos com o objetivo de não alterar drasticamente a estrutura e atividade destas enzimas e, com isso, melhorar estabilidade, eficácia, especificidade, diminuir sua imunogenicidade e garantir uma boa farmacocinética[70]. A peguilação, que é uma conjugação química com polietilenoglicol (PEG), é bastante utilizada para prolongar o tempo de permanência das proteases no sangue, além de promover sua liberação local-específica[71]. Embora a peguilação possa diminuir a imunogenicidade da proteína e aumentar a solubilidade, o principal benefício dessa modificação é a redução da frequência de doses devido à maior meia-vida na circulação do organismo[68].
Sistemas poliméricos de liberação de fármacos
O desenvolvimento de um sistema de liberação de fármacos deve levar em conta sua capacidade de incorporação, a possibilidade de liberação local-específica, a interação com moléculas biológicas, a taxa de degradação, o seu acúmulo em órgãos, a toxicidade e a possibilidade de produção em larga escala. A estabilidade físico-química das enzimas também precisa ser avaliada para a escolha do método de preparação da formulação, pois pode ser comprometida por fatores ambientais que fazem parte dos processos de produção, como pH, temperatura, alta pressão, solventes orgânicos, íons metálicos, agitação, dentre outros fatores que podem levar a perda da estrutura e atividade da proteína[6].
Os veículos poliméricos, além das suas características de degradação específicas, também deverão ser capazes de proteger a enzima terapêutica da proteólise, o que pode ser conseguido por incorporação de inibidores das enzimas proteolíticas na formulação ou por utilização de polímeros inibidores de peptidases, especificamente, os polímeros acrílicos reticulados como Carbopol® (carbomer) e polycarbophil. Pela rápida e elevada intumescência e dispersão destes polímeros em soluções aquosas, é bastante adequado incorporá-los a outros polímeros de natureza hidrofóbica de forma a controlar a taxa de erosão e minimizar o efeito na barreira de difusão[72,73].
Os diferentes sistemas poliméricos têm sido muito estudados para o transporte de proteases e de outras enzimas. Dentre eles temos as micro ou nanocápsulas, micro ou nanosferas, hidrogéis, dendrímeros e lipossomas (FIGURA 3). Estes sistemas são caracterizados por seu grau elevado de inovação e versatilidade e podem melhorar a farmacocinética oferecendo a liberação prolongada local-específica, a redução dos efeitos adversos e o aumento da biodisponibilidade dos fármacos biológicos[59].
O mecanismo de obtenção destas partículas representa um fator crucial para as suas características físico-químicas como tamanho, distribuição e morfologia, o que, em contrapartida, determina o comportamento destas em relação à encapsulação e a liberação do fármaco[74].
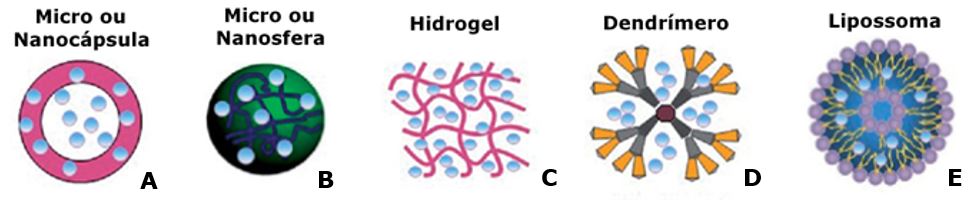
Estes sistemas poliméricos de entrega de fármacos podem ser determinados de acordo com o seu tamanho e dispersão. As partículas de diâmetro entre 1 a 1000 µm são chamadas de micropartículas e classificadas como microcápsulas ou microesferas. Já as com partículas coloidais de tamanho entre 10 e 1000 nm são determinadas como nanopartículas, nos quais o fármaco pode ser dissolvido, encapsulado ou disperso, recoberto e podem ser caracterizadas em nanocápsulas ou nanoesferas (FIGURA 3A e 3B)[75].
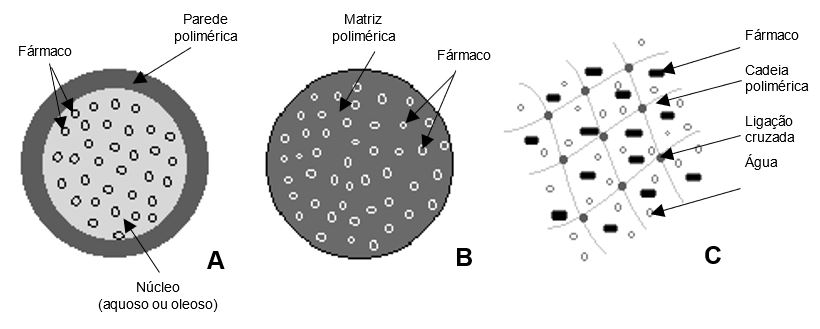
As micro ou nanocápsulas se referem a uma estrutura esférica com um núcleo bem definido, onde o fármaco fica localizado no interior de uma cavidade aquosa ou oleosa, circundada por uma membrana polimérica (FIGURA 4A). No entanto, a forma estrutural das micro ou nanosferas consiste em uma matriz única em que o fármaco se encontra disperso e encapsulado por um polímero biodegradável, tornando uma mistura homogênea (FIGURA 4B)[76]. O pequeno diâmetro das nanopartículas oferece vantagens sobre as micropartículas na administração e uma destas vantagens é a grande facilidade em atravessar o epitélio intestinal em relação as micropartículas[77].
Todas estas estruturas são compostas por polímeros biodegradáveis, como poliésteres, polianidridos e polissacarídeos que normalmente não geram toxicidade e nem dificuldade na eliminação pelo organismo. Os polímeros usados nas formulações de nanopartículas são os mesmos empregados para o preparo das micropartículas e são amplamente utilizados na administração controlada de fármacos com liberação prolongada, incluindo poliésteres sintéticos, como por exemplo, ácido poli-lático, copolímeros dos ácidos lático e glicólico (PLGA) e a poli(ε-caprolactona). Já os polímeros naturais incluem algumas proteínas como albumina, colágeno e gelatina e polissacarídeos como a quitosana[78,79].
Um outro sistema utilizado para liberação de fármacos é o hidrogel (FIGURA 3C), definido como uma estrutura tridimensional de cadeias poliméricas altamente porosa, que pode ser facilmente modelada pelo controle do número de ligações cruzadas, podendo absorver grande quantidade de água ou de fluído biológico (FIGURA 4C). Ele é sensível às variações do meio ambiente como de pH, campo elétrico, sinais mecânicos e pela presença de determinados resíduos químicos e biomoléculas, induzindo assim, modificações estruturais do hidrogel. Sua porosidade permite a liberação de fármacos a uma taxa que é dependente do coeficiente de difusão das moléculas do sistema polimérico para o alvo terapêutico de forma planejada[80,81]. Esses sistemas podem ser formulados numa grande variedade de formas físicas, incluindo formulações de depósito, micropartículas, nanopartículas, revestimentos e filmes[82].
Kashyap e colaboradores[83] desenvolveram um hidrogel biodegradável constituído por glicose ligada às cadeias de quitosana e com alta sensibilidade a variação do pH, que induz a liberação de insulina. A glicose oxidase converte a glicose em ácido glicurônico, na presença de oxigênio, que resulta na diminuição do pH, levando ao intumescimento do gel e consequente aumento da permeabilidade à água, facilitando, dessa forma, a liberação de insulina por difusão. A eficácia das formulações foi avaliada in vitro e em ratos diabéticos e os demonstrou que o sistema foi capaz de liberar insulina em resposta a hiperglicemia.
Outro nanosistema que pode ser utilizado no transporte de fármacos é o dendrímero (FIGURA 3D), formado por moléculas altamente ramificadas com: tamanho manométrico; forma e estrutura química bem específicas; com camadas ou gerações compostas por unidades repetidas e radialmente ligadas ao núcleo inicializador e grupos terminais funcionalizados; núcleo hidrofóbico com periferia hidrofílica; e baixa polidispersividade. Eles são muito semelhantes às proteínas do organismo humano, como insulina, hemoglobina e citocromo C e constituem sistemas de liberação de fármacos, pois são inertes ao organismo humano e exibem baixa toxidade e imunogenicidade[84,85].
As cargas úteis dos medicamentos podem ser aprisionadas nas camadas do dendrímero por meio da geração de complexos não-covalentes ou ligadas à sua superfície por meio de ligações covalentes. As macromoléculas dendríticas construídas covalentemente têm a vantagem de ter um controle mais específico sobre a liberação do fármaco e podem ser projetadas para limitar a liberação dele na circulação sistêmica e desencadear a liberação em condições específicas. O tipo de ligação depende das características físico-químicas do fármaco e dos grupamentos funcionais presentes no dendrímero. Por exemplo, as moléculas hidrofóbicas podem se ligar ao núcleo ou as ramificações do Poliamidoamina (PAMAM), facilitando seu carreamento através dos tecidos e células devido ao seu grande número de grupos superficiais que podem se ligar covalentemente a uma grande variedade de moléculas[85,86].
O lipossoma é um outro tipo de sistema polimérico utilizado para transporte e liberação de fármacos (FIGURA 3E). Pode ser composto por bicamadas lipídicas separadas por um meio aquoso, de estrutura esférica com moléculas anfifílicas e que pode encapsular substâncias hidrofílicas no núcleo aquoso e lipofílicas no interior da dupla camada lipídica[87]. A fluidez da bicamada lipídica permite a flexibilidade estrutural do lipossoma, a facilidade de interação com membranas celulares e a capacidade de incorporar compostos hidrossolúveis e lipossolúveis. Além disso eles são biodegradáveis, biocompatíveis e não imunogênicos[88].
Os lipossomas convencionais são compostos de fosfolipídeos e colesterol, além de um lipídeo com carga negativa ou positiva para evitar a agregação das vesículas, aumentando a estabilidade em suspensão. Os lipossomas de longa duração in vivo são obtidos por diferentes métodos, incluindo o revestimento da superfície lipossômica com componentes hidrofílicos naturais como o monossialogangliosideo GM1 e o fosfatidilinositol, ou de polímeros hidrofílicos sintéticos, mais especificamente os polietilenoglicóis (PEG). A camada hidrofílica superficial destes polímeros aumenta o tempo de circulação dos lipossomas prevenindo o reconhecimento e consequentemente sua associação com as opsoninas no plasma. Deste modo, os PEG inibem o reconhecimento molecular e a captura pelas células do sistema fagocitário mononuclear[89]. A modificação da superfície dos lipossomas com PEG pode ajudar a contornar estes problemas ao aumentar a sua estabilidade e o tempo de permanência no organismo e a ligação a anticorpos pode promover o direcionamento para o local de ação alvo[88].
Os lipídeos mais utilizados nas formulações de lipossomas são as fosfatidilcolinas, fosfatidilserina, fosfatidilglicerol e esfingomielinas, que tendem a formar uma bicamada estável em solução aquosa. As fosfatidilcolinas são as mais empregadas em estudos de formulação de lipossomas, porque apresentam grande estabilidade frente a variações de pH ou da concentração de sal no meio[89].
Métodos para incorporação de proteínas e peptídeos
O preparo dos sistemas poliméricos depende de métodos eficazes de incorporação de enzimas, como as proteases terapêuticas, de proteínas e peptídeos em geral, os quais permitem a modulação das estruturas, das composições e das propriedades fisiológicas destas macromoléculas[90,91]. A escolha da metodologia de preparo vai depender do polímero e da solubilidade do fármaco a ser encapsulado. Para a incorporação de peptídeos e proteínas, os métodos mais usados são os de emulsão múltipla, separação de fase e de secagem por aspersão (spray drying)[92].
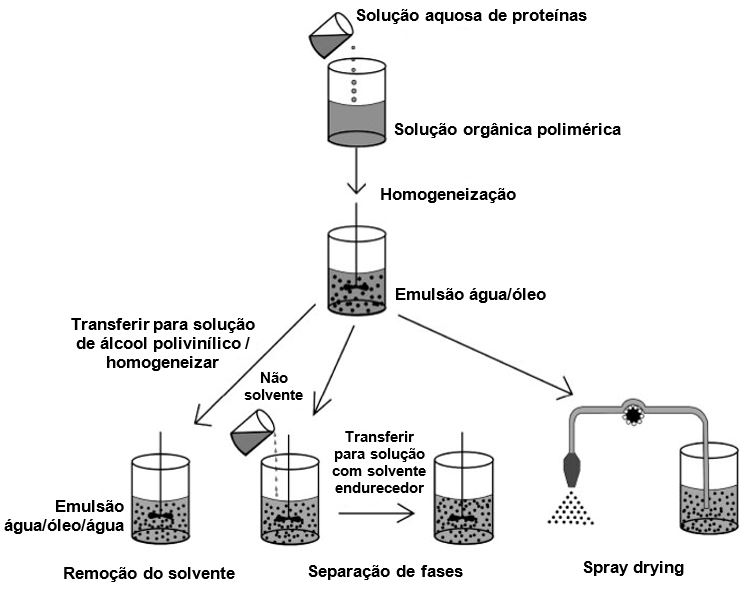
Primeiramente, uma emulsão de água em óleo deve ser obtida pela dispersão de uma solução aquosa com a enzima/proteína ou peptídeo a ser encapsulado em um solvente orgânico, contendo já o polímero dissolvido. Neste método a solução é emulsificada com uma grande quantidade de meio aquoso, para formar uma emulsão múltipla de água em óleo em água, onde a proteína se encontra na fase aquosa interna e o polímero na fase orgânica (ou oleosa). Os sistemas poliméricos são posteriormente formados pela remoção do solvente, como mostrado na FIGURA 5[59].
No método de separação de fases (FIGURA 5), um não-solvente é adicionado sobre agitação à emulsão de água em óleo obtida, onde a proteína se encontra na fase aquosa interna e o polímero na fase orgânica (ou oleosa), induzindo a aglomeração das moléculas de proteínas e transformando o sistema coloidal estável em soluções não miscíveis de diferentes concentrações[59].
A secagem por aspersão, mostrada na FIGURA 5, é realizada a partir de uma emulsão água/óleo com partículas poliméricas carregadas com proteases terapêuticas, que apresentam características homogêneas para permitir maior precisão e reprodutibilidade dose a dose. Para isso, o spray drying (SD) é utilizado na obtenção de partículas poliméricas carregadas com enzimas terapêuticas na forma de pó-seco. Ele é um método de secagem para obtenção de "pós secos" a partir de uma fase líquida, bastante empregado nas indústrias alimentícias, farmacêuticas, de polímeros e química. No caso do encapsulamento das proteases terapêuticas em esferas ou cápsulas, o pó-seco pode ser obtido a partir de uma solução, suspensão ou emulsão. As proteases são "melhor" preservadas sob a forma de "pós secos", pois aumenta a estabilidade durante o armazenamento devido à eliminação da água, sendo assim, SD também usado como método de preservação. Esta é uma técnica reprodutível e rápida, podendo ser realizada com o aumento de escala (scale up), além da produção de partículas estáveis sem necessidade de liofilização. O SD é um processo contínuo e dividido em quatro estágios: atomização, mistura das gotículas com o gás secante, evaporação e separação do produto. O grande problema das técnicas de evaporação de solvente é a limitação tecnológica que ainda não permite a produção das partículas em larga escala[93].
Para a nanoencapsulação dos fármacos que apresentam caráter hidrofílico, o método físico-químico da dupla emulsão apresenta-se como o mais adequado. Ele é conceitualmente simples, consistindo na preparação de uma emulsão primária água/óleo, através da sonicação de uma solução aquosa contendo o fármaco e uma solução orgânica polimérica. Esta emulsão constitui a fase interna da segunda emulsão, também preparada por sonicação, cuja fase externa é uma solução aquosa com tensoativo. A preparação das formulações de nanopartículas por este método requer a presença de um agente emulsificante para estabilizar a fase dispersa em uma emulsão múltipla água/óleo/água. O agente emulsionante, neste caso, é requerido para prevenir a agregação e a coalescência das partículas[94].
O desenvolvimento de novas técnicas de formulação possibilitou que as proteínas, especialmente as enzimas, como proteases de plantas, pudessem constituir composições farmacêuticas cada vez mais utilizadas no tratamento de enfermidades e condições. Estes fármacos biológicos formulados sob forma de micro/nanopartículas tornaram-nos cada vez mais estáveis, eficientes, específicos e, portanto, menos tóxicos para seus usuários.
Conclusão
As proteases terapêuticas de plantas, como papaína, bromelaína, ficina, dentre outras, têm conquistado um lugar importante no tratamento de muitas doenças e condições. Além de serem específicas, tem grande poder de catálise, apresentam elevada estabilidade e baixo custo de obtenção. As formulações desenvolvidas com estratégias de nanopartículas poliméricas são as mais indicadas para proteção das proteases e seu direcionamento ao alvo terapêutico. Uma análise aprofundada da literatura permitiu concluir que as nanopartículas poliméricas, hidrogéis, lipossomas e dendrímeros, têm mostrado excelentes resultados como transportadores de proteases, além de proteção dos fármacos contra a degradação ao ambiente que atuam.
Fontes de Financiamento
FIOCRUZ - Farmanguinhos.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
À Farmanguinhos/Fiocruz e ao CNPq.
Colaboradores
Concepção do estudo: RESL; PFF
Curadoria dos dados: RESL; PFF
Coleta de dados: RESL; PFF
Análise dos dados: RESL; PFF
Redação do manuscrito original: RESL; PFF
Redação da revisão e edição: RESL; PFF.
Referências
1. Henriques SR, Ferreira JWS, Muniz MP, Albuquerque UP. Adaptive memory and evolution of the human naturalistic mind: Insights from the use of medicinal plants. PLoS One. 2019; 14(3): e0214300. [https://doi.org/10.1371/journal.pone.0214300].
2. Rehman HM, Cooper JW, Lam HM, Yang SH. Legume biofortification is an underexploited strategy for combatting hidden hunger. Plant Cell Environ. 2019; 42(1): 52-70. [https://doi.org/10.1111/pce.13368].
3. Turunen P, Rowan AE, Blank K. Single-enzyme kinetics with fluorogenic substrates: lessons learnt and future directions. FEBS Lett. 2014; 588: 3553-3563. [https://doi.org/10.1016/j.febslet.2014.06.021].
4. Depreter F, Pilcer G, Amighi, K. Inhaled Proteins: Challenges and perspectives. Int J Pharmaceutics. 2013; 447: 251-280. [https://doi.org/10.1016/j.ijpharm.2013.02.031].
5. Botelho SM. Novas estratégias de administração de proteínas e peptídeos. Coimbra. 2014. 32f. Monografia, Mestrado Integrado [em Ciências Farmacêuticas] - Faculdade de Farmácia, Universidade de Coimbra. Portugal. 2014. [https://estudogeral.uc.pt/bitstream/10316/80572/1/M_sofia%20botelho.pdf].
6. Prado FK. Desenvolvimento de método analítico para quantificação de antineoplásico em sistemas de liberação controlada de fármacos. São Paulo. 2019. Dissertação de Mestrado [Programa de Pós-Graduação em Fármacos e Medicamentos] - Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, USP. São Paulo. 2019. [http://www.teses.usp.br/teses/disponiveis/9/9139/tde-31072019-113148/].
7. Vizovišek M, Vidmar R, Drag M, Fonović M, Salvesen GS, Turk B. Protease specificity: towards in vivo imaging applications and biomarker discovery. Trends Bioche Sci. 2018; 43(10): 829-844. [https://doi.org/10.1016/j.tibs.2018.07.003].
8. Bond JS. Proteases: History, discovery, and roles in health and disease. J Biol Chem. 2019; 294:1643-1651. [https://doi.org/10.1074/jbc.TM118.004156].
9. Rawlings ND, Barrett AJ, Thomas PD et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Res. 2018; 46(D1): D624-D632. [https://doi.org/10.1093/nar/gkx1134].
10. Mandujano-González V, Villa-Tanaca L, Anducho-Reyes MA, Mercado-Flores Y. Secreted fungal aspartic proteases: A review. Rev Iberoam Micol. 2016; 33: 76-82. [https://doi.org/10.1016/j.riam.2015.10.003].
11. Baker PJ, Numata K. Polymerization of peptide polymers for biomaterials applications. Polymer Sci. Intech Open, 2013. ISBN: 978-953-51-6294-0.
12. Van der Hoorn RA, Jones JD. The plant proteolytic machinery and its role in defence. Curr Opin Plant Biol. 2004; 7: 400-407. [https://doi.org/10.1016/j.pbi.2004.04.003].
13. Van der Hoorn RAL. Plant proteases: From phenotypes to molecular mechanisms. Annu Rev Pl Biol. 2008; 59: 191–223. [https://doi.org/10.1146/annurev.arplant.59.032607.092835].
14. Kurepa J, Wang S, Li Y et al. Proteasome regulation, plant growth and stress tolerance. Pl Signal Behav. 2009; 4: 924-927. [https://doi.org/10.4161/psb.4.10.9469].
15. Li Q, Yi L. Commercial proteases: Present and future. FEBS Lett. 2013; 587: 1155–1163. [https://doi.org/10.1016/j.febslet.2012.12.019].
16. Rawlings ND, Barrett AJ, Thomas PD et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Res. 2018; 46(D1): D624-D632. [https://doi.org/10.1093/nar/gkx1134].
17. SilvaLópez RE. Immunocytochemistry of proteases in the study of Leishmania physiology and host-parasite interaction in applications of immunocytochemistry In: Dehghani H, editor. Applications of immunocytochemistry. InTech, Rijeka. 2012; 267–296. [https://doi.org/10.5772/32954].
18. Rawlings ND, Barrett AJ, Thomas PD et al. The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Res. 2018; 46(D1): D624–D632. [https://doi.org/10.1093/nar/gkx1134].
19. McCauley JA, Rudd MT. Hepatitis C virus NS3/4a protease inhibitors. Curr Opin Pharmacol. 2016; 30: 84-92. [https://doi.org/10.1016/j.coph.2016.07.015].
20. Craik CS, Page MJ, Madison EL. Proteases as therapeutics. Biochem. 2011; 435: 1–16. [https://doi.org/10.1042/BJ20100965].
21. Schwaminger SP, Fraga-García P, Eigenfeld M, Becker TM, Berensmeier S. Magnetic Separation in Bioprocessing Beyond the Analytical Scale: From Biotechnology to the Food Industry. Front Bioeng Biotechnol. 2019; 7: 233. [https://doi.org/10.3389/fbioe.2019.00233].
22. Gavrilescu M, Chisti Y. Biotechnology-a sustainable alternative for chemical industry. Biotechnol Adv. 2005; 23: 471-499. [https://doi.org/10.1016/j.biotechadv.2005.03.004].
23. de Souza PM, Bittencourt ML, Caprara CC, de Freitas M, de Almeida RP, Silveira D et al. A biotechnology perspective of fungal proteases. Braz J Microbiol. 2015; 46: 337-46. [https://doi.org/10.1590/S1517-838246220140359].
24. Oliveira LG, Mantovani SM. Transformações biológicas: contribuições e perspectivas Quim Nova. 2009; 32: 742-756. [https://doi.org/10.1590/S0100-40422009000300018].
25. Chapman J, Ismail AE, Dinu CZ. Industrial Applications of Enzymes: Recent Advances, Techniques, and Outlooks. Catalysts. 2018; 8: 238. [https://doi.org/10.3390/catal8060238].
26. Vellard M. The enzyme as drug: application of enzymes as pharmaceuticals. Curr Opin Biotechnol. 2003; 14: 444-450. [https://doi.org/10.1016/S0958-1669(03)00092-2]. PMid: 12943856.
27. Abdel Raheem A, Johnson M, Ralph D, Garaffa G. Collagenase clostridium histolyticum: a novel medical treatment for Peyronie's disease. Minerva Urol Nefrol. 2018; 70: 380-385. [https://doi.org/10.23736/S0393-2249.18.03118-1]. PMid: 29761688.
28. Kido H, Takahashi E, Kimoto T. Role of host trypsin-type serine proteases and influenza virus-cytokine-trypsin cycle in influenza viral pathogenesis. Pathogenesis-based therapeutic options. Biochimie. 2019; 166: 203-213. [https://doi.org/10.1016/j.biochi.2019.09.006]. PMid:31518617.
29. Leite AP, de Oliveira BG, Soares MF, Barrocas DL. Use and effectiveness of papain in the wound healing process: a systematic review. Rev Gaucha Enferm. 2012; 33: 198-207. [https://doi.org/10.1590/S1983-14472012000300026]. PMid:23405827.
30. Sato K, Egami F. Studies on ribonucleases in takadiastase. Int J Biochem. 1957; 44: 753-767. [https://doi.org/10.1093/oxfordjournals.jbchem.a126717].
31. Pacheco JS, Silva-López RE. Study of the proteolytic activity of the tropical legume Crotalaria spectabilis. Z Naturforsch. 2012; 67: 495– 509. [https://doi.org/10.1515/znc-2012-9-1008]. PMid:23198408.
32. Menou A, Duitman JW, Crestani B. The impaired proteases and anti-proteases balance in idiopathic pulmonary fibrosis. Matrix Biol. 2018; 68: 382-403. [https://doi.org/10.1016/j.matbio.2018.03.001]. PMid:29518524.
33. Silva-López RE, Gonçalves RN. Therapeutic proteases from plants: biopharmaceuticals with multiple applications. J Appl Biotechnol Bioeng. 2019; 6: 101-109. [https://doi.org/10.15406/jabb.2019.06.00180].
34. Silva-López, RE. Debridement applications of bromelain: a complex of cysteine proteases from pineapple. Adv Biotechnol Microbiol, 2017; 3: 1-3. [https://doi.org/10.19080/AIBM.2017.03.555624].
35. Feijoo-Siota L, Villa T G. Native and Biotechnologically Engineered Plant Proteases with Industrial Applications. Food and Bioprocess Technol. 2011; 4: 1066–1088. [https://doi.org/10.1007/s11947-010-0431-4].
36. Andrew C. Storer AC, Ménard R. Papain. Handbook of Proteolytic Enzymes. 2013; 2:1858-1861. [https://doi.org/10.1016/B978-0-12-382219-2.00418-X].
37. Novinec M, Lenarčič B. Papain-like peptidases: structure, function, and evolution. Biomol Concepts. 2013; 4(3): 287–308. [https://doi.org/10.1515/bmc-2012-0054]. PMid: 25436581.
38. Rawlings ND, Barrett AJ, Finn R. Twenty years of the MEROPS database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Res. 2016; 44(1): 343-350. [https://doi.org/10.1093/nar/gkv1118]. PMid: 26527717 PMCid: PMC4702814
39. Amri E, Mamboya F. Papain, a plant enzyme of biological importance: a review. Am J Biochem Biotech. 2012; 8: 99-104. [https://doi.org/10.3844/ajbbsp.2012.99.104].
40. Dos Anjos MM, Da Silva AA, De Pascoli IC et al. Antibacterial activity of papain and bromelain on Alicyclobacillus spp. Int J Food Microbiol. 2016; 216: 121–126. 27. [https://doi.org/10.1016/j.ijfoodmicro.2015.10.007]. PMid:26476327.
41. Moraes D, Levenhagen MA, Costa-Cruz JM et al. In vitro efficacy of latex and purified papain from Carica papaya against Strongyloides venezuelensis eggs and larvae. Rev Inst Med Trop. 2017; 9. [https://doi.org/10.1590/s1678-9946201759007].
42. Mota VS, Turrini RNT, Poveda VB. Antimicrobial activity of Eucalyptus globulus oil, xylitol and papain: a pilot study. Rev Esc Enferm. 2015; 49: 216–220. [https://doi.org/10.1590/S0080-623420150000200005]. PMid: 25992819.
43. Müller A, Barat S, Chen X, Bui KC, Bozko P, Malek NP, Plentz RR. Comparative study of antitumor effects of bromelain and papain in human cholangiocarcinoma cell lines. Int J Oncol. 2016; 48(5): 2025-34. [https://doi.org/10.3892/ijo.2016.3411]. PMid: 26935541.
44. Leite AP, De Oliveira BG, Soares MF et al. Use and effectiveness of papain in the wound healing process: a systematic review. Rev Gaúcha Enf.2012; 33: 198-207. [https://doi.org/10.1590/S1983-14472012000300026].
45. Shindo T, Van de Hoorn RAL. Papain-like cysteine proteases: key players at molecular battlefields employed by both plants and their invaders. Mol Plant Pathol. 2008; 9: 119–125. [https://doi.org/10.1111/j.1364-3703.2007.00439.x].
46. Chen YY, Lu YH, Ma CH et al. A novel elastic liposome for skin delivery of papain and its application on hypertrophic scar. Biomed Pharmacother. 2017; 87: 82–91. [https://doi.org/10.1016/j.biopha.2016.12.076].
47. De Lencastre Novaes LC, Jozala AF, Lopes AM et al. Stability, purification, and applications of bromelain: a review. Biotechnol Prog. 2016; 3(2): 5-13. [https://doi.org/10.1002/btpr.2190].
48. Taussig SJ, Batkin S. Bromelain, the enzyme complex of pineapple (Ananas comosus) and its clinical application. J Ethnopharmacol. 1988; 22: 191-203. [https://doi.org/10.1016/0378-8741(88)90127-4].
49. Bhui K, Prasad S, George J, Shukla Y. Bromelain inhibits COX-2 expression by blocking the activation of MAPK regulated NFkappa B against skin tumor-initiation triggering mitochondrial death pathway. Cancer Lett. 2009; 282: 167-176. [https://doi.org/10.1016/j.canlet.2009.03.003].
50. Mynott TL, Guandalini S, Raimondi F, Fasano A. Bromelainprevents secretion caused by Vibrio cholerae and Escherichia coli enterotoxins in rabbit ileum in vitro. Gastroenterol. 1997; 113(1): 175-84. [https://doi.org/10.1016/S0016-5085(97)70093-3].
51. Secor ER, Szczepanek SM, Castater CA, Adami AJ, Matson AP, Rafti ET et al. Bromelain inhibits alergic sensitization and murine asthma via modulation of dendritic cells. Evid Based Compl Alternat Med. 2013; 2013. [https://doi.org/10.1155/2013/702196].
52. Jayachandran S, Khobre P. Efficacy of bromelainalong with trypsin, rutoside trihydrate enzymes and diclofenac sodium combination therapy for the treatment of TMJ Osteoarthritis - A randomised clinical trial. J Clin Diagn Res. 2017 Jun; 11(6): 09-11. [https://doi.org/10.7860/JCDR/2017/25771.9964].
53. Baeyens-Volant D, Matagne A, El Mahyaoui R et al. A novel form of ficin from Ficus carica latex: purification and characterization. Phytochem. 2015; 117: 154-167. [https://doi.org/10.1016/j.phytochem.2015.05.019].
54. Shahidi S, Jamili S, Ghavam Mostafavi P, Rezaie S, Khorramizadeh M. Assessment of the inhibitory effects of ficin-hydrolyzed gelatin derived from squid (Uroteuthis duvauceli) on breast cancer cell lines and animal model. Iran J Allergy Asthma Immunol. 2018; 17: 436-452. [https://doi.org/10.18502/ijaai.v17i5.302].
55. Raskovic B, Lazic J, Polovic N. Characterisation of general proteolytic, milk clotting and antifungal activity of Ficus carica latex during fruit ripening. J Sci Food Agric. 2016; 96: 576–582. [https://doi.org/10.1002/jsfa.7126].
56. Storpirtis S, Gonçalves JE, Chiann C, Gai MN. Ciências farmacêuticas: Biofarmacotécnica. Ed. Guanabara Koogan, Rio de Janeiro, 2009.
57. Nasciutti PR. Desenvolvimento de novos fármacos. Goiás, 2012. Seminário Aplicado [Programa de Pós-Graduação em Ciência Animal] - Escola de Veterinária e Zootecnia da Universidade Federal de Goiás, UFGO. Goiás, 2012. [https://files.cercomp.ufg.br/weby/up/67/o/1%C2%B0_Semin%C3%A1rio_PRISCILLA_NASCIUTTI.pdf?1350665635].
58. Loyd V, Allen Jr, Nicholas GP, Howard CA. Formas Farmacêuticas e Sistemas de Liberação de Fármacos. Ed. Artmed 9ª ed, 2013.
59. Melo CS, Junior AC, Fialho SL. Formas farmacêuticas poliméricas para a administração de peptídeos e proteínas terapêuticos. Rev Ciênc Farm Básica Apl. 2012; 33(4): 469-477. [https://rcfba.fcfar.unesp.br/index.php/ojs/article/view/249].
60. McClements DJ. Encapsulation, protection, and delivery of bioactive proteins and peptides using nanoparticle and microparticle systems: a review. Adv Colloid Interface Sci. 2018; 253: 1-22. [https://doi.org/10.1016/j.cis.2018.02.002].
61. Almeida AJ, Souto E. Solid lipid nanoparticles as drug delivery systems for peptides and proteins. Adv Drug Del Rev. 2007; 59(6): 478-90. [https://doi.org/10.1016/j.addr.2007.04.007].
62. Feitosa RC, Geraldes DC, de-Araújo BVL, Costa JSR, Oliveira-Nascimento L. Pharmacokinetic aspects of nanoparticle-in-matrix drug delivery systems for oral/buccal delivery. Front Pharmacol. 2019; 10: 1057. [https://doi.org/10.3389/fphar.2019.01057].
63. Bizerra A, Silva V. Sistemas de liberação controlada: mecanismos e aplicações. Rev Saúde Meio Amb - RESMA. 2016; 3(2): 1-12. [https://periodicos.ufms.br/index.php/sameamb/article/view/1943].
64. Moeller EH, Jorgensen L. Alternative routes of administration for systemic delivery of protein pharmaceuticals. Drug Discov Today Technol. 2008; 5(2-3): 89-94. [https://doi.org/10.1016/j.ddtec.2008.11.005].
65. Silva AC, Lopes CM, Lobo JMS, Amaral MH. Delivery systems for biopharmaceuticals. Part I: Nanoparticles and Microparticles. Current Pharmaceutic Biotechnol. 2015; 16: 940-954. [https://doi.org/10.2174/1389201016666150731112532].
66. Lin YW, Zhou QT, Hu Y, Onufrak NJ, Sun S, Wang J, Forrest A, Chan HK, Li J. Pulmonary pharmacokinetics of colistin following administration of dry powder aerosols in rats. Antimicrob Agents Chemother. 2017; 61(11). [https://doi.org/10.1128/AAC.00973-17].
67. Steiner V, Öhlinger K, Corzo C, Salar-Behzadi S, Fröhlich E. Cytotoxicity screening of emulsifiers for pulmonary application of lipid nanoparticles. Eur J Pharm Sci. 2019; 136: 104968. [https://doi.org/10.1016/j.ejps.2019.104968].
68. Mitragotri S, Burke PA, Langer R. Overcoming the challenges in administering biopharmaceuticals: formulation and delivery strategies. Nat Rev Drug Discov. 2014; 13(9): 655-72. [https://doi.org/10.1038/nrd4363].
69. Griffin BT, Guo J, Presas E, Donovan MD, Alonso MJ, O'Driscoll CM. Pharmacokinetic, pharmacodynamic and biodistribution following oral administration of nanocarriers containing peptide and protein drugs. Adv Drug Deliv Rev. 2016; 106: 367-380. [https://doi.org/10.1016/j.addr.2016.06.006].
70. Muheem A, Shakeel F, Jahangir MA, Anwar M, Mallick N, Jain GK et al. A review on the strategies for oral delivery of proteins and peptides and their clinical perspectives. Saudi Pharmaceutical J. 2016; 24: 413-428. [https://doi.org/10.1016/j.jsps.2014.06.004].
71. Blanco E, Shen H, Ferrari M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 2015; 33(9): 941–951. [https://doi.org/10.1038/nbt.3330].
72. Bai JP, Chang LL, Guo JH. Effects of polyacrylic polymers on the lumenal proteolysis of peptide drugs in the colon. J Pharm Sci.1995; 84: 1291-1294. [https://doi.org/10.1002/jps.2600841107].
73. Silva C, Ribeiro A, Ferreira D, Veiga F. Administração oral de peptídios e proteínas: Estratégias gerais para aumento da biodisponibilidade oral. Rev Bras Cienc Farm. 2002; 38:125-140. [https://doi.org/10.1590/S1516-93322002000200002].
74. Réus M, Carmignan F, Lemos Senna E, Campos AM. Nanopartículas Poliméricas na Administração Tópica Ocular de Fármacos. Lat Am J Pharm. 2009; 28: 125-132.
75. Zhang L, Wang S, Zhang M, Sun J. Nanocarriers for oral drug delivery. J Drug Target. 2013; 21: 515-527. [https://doi.org/10.3109/1061186X.2013.789033].
76. Wang L, Liu Y, Zhang W, Chen X, Yang T, Ma G. Microspheres and microcapsules for protein delivery: Strategies of drug activity retention. Curr Pharm Des. 2013; 19: 6340-6352. [https://doi.org/10.2174/1381612811319350010].
77. Reis CP, Neufeld RJ, Ribeiro AJ, Veiga F. Nanoencapsulation II. Biomedical applications and current status of peptide and protein nanoparticulate delivery systems. Nanomedicine. 2006; 2: 53-65. [https://doi.org/10.1016/j.nano.2006.04.009].
78. Lu XY, Wu DC, Li ZJ, Chen GQ. Polymer nanoparticles. Prog Mol Biol Transl Sci. 2011; 104: 299-323. [https://doi.org/10.1016/B978-0-12-416020-0.00007-3].
79. Qodratnama R, Serino LP, Cox HC, Qutachi O, White LJ. Formulations for modulation of protein release from large-size PLGA microparticles for tissue engineering. Mater Sci Eng C Mater Biol Appl. 2015; 47: 230-6. [https://doi.org/10.1016/j.msec.2014.11.003].
80. Liu Y, Lu W, Wang J, Zhang X, Zhang H, Wang X et al. Controlled delivery of recombinant hirudin based on thermo-sensitive Pluronic® F127 hydrogel for subcutaneous administration: in vitro and in vivo characterization. J Control Release. 2007; 117: 387-95. https://doi.org/10.1016/j.jconrel.2006.11.024
81. Sokker HH, Abdel Ghaffar AM, Gad YH, Aly AS. Synthesis and characterization of hydrogels based on grafted chitosan for the controlled drug release. Carbohyd Polym. 2009; 75: 222-229. https://doi.org/10.1016/j.carbpol.2008.06.015
82. Hoare TR, Kohane DS. Hydrogels in drug delivery: progress and challenges. Polymer. 2008; 49: 1993-2007. https://doi.org/10.1016/j.polymer.2008.01.027
83. Kashyap N, Viswanad B, Sharma G, Bhardwaj V, Ramarao P, Kumar MNV. Design and evaluation of biodegradable, biosensitive in situ gelling system for pulsatile delivery of insulin. Biomaterials. 2007; 28: 2051-2060. https://doi.org/10.1016/j.biomaterials.2007.01.007
84. Nanjwade BK, Bechra HM, Derkar GK, Manvi FV, Nanjwade VK. Dendrimers: emerging polymers for drug-delivery systems. Eur J Pharm Sci. 2009; 38: 185-196. https://doi.org/10.1016/j.ejps.2009.07.008
85. Pimenta LFC. Influência de dendrímeros e da iontoforese na penetração da protoporfirina IX em tumores cutâneos. Ribeirão Preto. 2013. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, USP, Ribeirão Preto, SP. 2013. [https://doi.org/10.11606/D.60.2013.tde-18122013-093754].
86. Onoue S, Yamada S, Chan HK. Nanodrugs: pharmacokinetics and safety. Int J Nanomedicine. 2014; 9: 1025-1037. https://doi.org/10.2147/IJN.S38378
87. D"Abreu DP. Sistemas de nanopartículas híbridas para veiculação de DNA. Lisboa. 2017. Monografia, Mestrado Integrado [em Ciências Farmacêuticas] - Faculdade de Farmácia. Universidade de Lisboa. Lisboa. Portugal. 2017. [https://repositorio.ul.pt/bitstream/10451/36115/1/MICF_Diana_Pereira_DAbreu.pdf].
88. Coutinho JA. Nanopartículas na entrega eficaz e segura de fármacos ao cérebro por via nasal Experiência Profissionalizante na vertente de Farmácia Comunitária, Hospitalar e Investigação. Covilhã. 2015. 138f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] – Ciências da Saúde. Universidade da Beira Interior, Covilhã. Portugal. 2015. [https://ubibliorum.ubi.pt/handle/10400.6/5324].
89. Batista CM, Carvalho CMB, Magalhães NSS. Lipossomas e aplicações terapêuticas: Estado da arte. Braz J Pharma Sci. 2007; 43: 25-38. https://doi.org/10.1590/S1516-93322007000200003
90. Dés Rieux A, Fievez V, Garinot M, Schneider Y, Préat V. Nanoparticles as potential oral delivery systems of proteins and vaccines: A mechanistic approach. J Control Release. 2006; 116: 1-27. https://doi.org/10.1016/j.jconrel.2006.08.013
91. Grabnar PA, Kristl J. The manufacturing techniques of drug-loaded polymeric nanoparticles from preformed polymers. J Microencapsul. 2011; 28: 323-35. https://doi.org/10.3109/02652048.2011.569763
92. Mundargi RC, Babu VR, Rangaswamy V, Patel P, Aminabhavi TM. Nano/micro technologies for delivering macromolecular therapeutics using poly(d,l-lactide-co-glycolide) and its derivatives. J Control Release. 2008; 125: 193-209. https://doi.org/10.1016/j.jconrel.2007.09.013
93. Ré MI. Formulating Drug Delivery Systems by Spray Drying. Drying Technol. 2006; 24: 433-446. https://doi.org/10.1080/07373930600611877
94. Mishra D K, Ashish KP, Prateek KJ. A review on various techniques of microencapsulation. Int J Pharma Chem Sci. 2013; 2: 172-205. [https://ijpcsonline.com/files/files/66-524.pdf].