Artigo de Pesquisa
Extração de substâncias pécticas do mesocarpo de Passiflora nitida Kunth. Passifloraceae
Extraction of pectic substances from the mesocarp of Passiflora nitida Kunth. Passifloraceae
Resumo
Passiflora nitida Kunth. (maracujá-do-mato) nativa do Brasil com ocorrências nas regiões norte, nordeste e centro-oeste. O fruto é consumido in natura, sendo pouco explorado quanto as suas propriedades funcionais. O objetivo deste estudo, foi extrair substâncias pécticas do mesocarpo de P. nitida. O mesocarpo foi desidratado, triturado e obtido um pó de fina granulação, caracterizado quanto a granulometria, índice de intumescência, acidez titulável, cinzas e teor de umidade. Para a extração de substâncias pécticas foi utilizado 4 g do pó em meio ácido. As amostras foram separadas em 2 grupos: grupo 1 foi utilizado ácido L-ascórbico P.A. (marca NEON) e no grupo 2, suco de limão da fruta in natura, ambos na concentração de 5% usando a temperatura de 60ºC por 120 minutos e 80ºC por 60 minutos. O rendimento das substâncias pécticas do grupo 1 foi de 12,2 ± 0,3% a 60ºC por 120 minutos e de 12,9 ± 0,2% a 80ºC por 60 minutos. Para o grupo 2 foi de 14,3 ± 0,2% e de 17,9 ± 0,3%, respectivamente. O mesocarpo de P. nitida poderá ser uma fonte para obtenção de substâncias pécticas.
- Palavras-chave:
- Maracujá-do-mato.
- Pectina.
- Subprodutos.
- Amazônia.
Abstract
Passiflora nitida Kunth. (maracujá-do-mato) native to Brazil with occurrences in the north, northeast and midwest regions. The fruit is consumed in natura, being little explored as to its functional properties. The aim of this study was to extract pectic substances from the P. nitida mesocarp. The mesocarp was dehydrated, crushed and a fine-grained powder was obtained, characterized in terms of granulometry, swelling index, titratable acidity, ash and moisture content. For the extraction of pectic substances, 4 g of the powder was used in an acid medium. The samples were separated into 2 groups: group 1 was used L-Ascorbic Acid P.A. (brand NEON) and in group 2, fresh fruit lemon juice, both at a concentration of 5% using a temperature of 60ºC for 120 minutes and 80ºC for 60 minutes. The yield of pectic substances in group 1 was 12,2 ± 0,3% at 60ºC for 120 minutes and 12,9 ± 0,2% at 80ºC for 60 minutes. For group 2 it was 14,3 ± 0,2% and 17,9 ± 0,3%, respectively. The P. nitida mesocarp may be a source for obtaining pectic substances.
- Keywords:
- Maracujá-do-mato.
- Pectin.
- Byproduct.
- Amazon.
Introdução
As substâncias pécticas constituem uma família de oligossacarídeos e polissacarídeos, presentes nas paredes celulares das plantas contribuindo na integridade e rigidez do tecido, sendo abundante em muitas frutas[1-4]. São polímeros heterogêneos de estrutura complexa constituída de uma cadeia principal linear de unidades repetidas de α-D-ácido galacturônico, esterificada com grupos metílicos, formando o ácido poligalacturônico ou grupos livres de ácidos[4-7].
Polímeros amplamente utilizados como agente gelificante, emulsificante e estabilizante nas indústrias alimentícias (na produção de goma, geleias, produtos lácteos, entre outros)[8,9] e com aplicações crescentes na indústria farmacêutica (como fibras dietéticas solúveis com efeitos benéficos na redução dos níveis de colesterol, lipoproteínas e ácidos biliares)[10,11]. As substâncias pécticas podem estar presentes na formulação de medicamentos associadas a polímeros naturais ou sintéticos, como material de revestimento de formas farmacêuticas e em sistemas terapêuticos específicos, naturais ou como compostos derivados, facilitando a liberação de fármacos devido à sua baixa toxicidade, baixo custo e alta estabilidade[12,13].
A exploração de resíduos como matérias-primas estabelece uma das etapas essenciais no processo industrial, evidenciando crescente preocupação com esses materiais, tanto do ponto de vista industrial quanto ambiental[14]. Com isso, reduzir os desperdícios de alimentos através do reaproveitamento de matérias-primas tornou-se uma alternativa que tem sido usada no desenvolvimento de novos produtos, mostrando-se uma proposta concreta e rentável, visto que esses resíduos representam relevantes fontes de materiais considerados importantes na produção industrial, como é o caso da pectina[15].
Existem estudos sobre extração de substâncias pécticas de diferentes fontes, ressaltando o aproveitamento de subprodutos na produção de compostos industrialmente relevantes e perfeitamente passiveis de serem incluídos na alimentação humana[15]. A maior parte das substâncias pécticas utilizadas pela indústria são originadas de subprodutos como bagaço da maçã e casca de frutas cítricas que são consideradas ricas em pectina[16,17]; outras matérias primas como bagaço da laranja[18], miolo do girassol[19], casca da manga[20], casca da banana[21], goiaba[22] e casca de maracujá[14,23-26] vem sendo estudadas como fontes alternativas para a extração dessas substâncias.
Entre os frutos encontrados na amazônica, destaca-se o Passiflora nitida Kunth., Passifloraceae, conhecida popularmente como maracujá-do-mato, maracujá-suspiro, maracujá-de-cheiro e maracujá-de-rato[27-29]. A espécie é encontrada dispersa por todo norte da América do Sul[30]. O fruto silvestre é apreciado pela população do norte do Brasil com boa aceitabilidade para consumo in natura, devido ao seu sabor doce[29,31], não havendo registro de outras formas de consumo (sucos, geleias, cremes, entre outros). Pesquisas sobre a espécie demonstram atividades antimicrobiana[32], antioxidante, anticoagulante e antiagregante plaquetária do extrato das folhas[30] ou efeito hipoglicemiante da farinha do mesocarpo desidratado[33].
Existem poucas pesquisas a respeito do fruto P. nitida e nenhuma informação sobre a utilização do mesocarpo para extração de substâncias pécticas. Dessa forma, o objetivo deste estudo foi extrair substâncias pécticas da farinha do mesocarpo de P. nitida como forma de agregar valor ao fruto e apresentar uma alternativa de aproveitamento do mesocarpo, o qual teria como destino o descarte.
Material e Métodos
Coleta dos frutos
Os frutos de P. nitida (FIGURA 1)foram obtidos comercialmente em feiras livres do município de Santarém-Pará. Os frutos foram higienizados, separadas as suas partes, sendo mensurado o rendimento levando em consideração as seguintes partes dos frutos separadamente: polpa, mesocarpo e casca. A exsicata da espécie foi coletada pela Msc Chienno Shuemitsu e encontra-se depositada no herbário da Universidade Federal do Oeste do Pará sob o número HSTM 471.
O mesocarpo utilizado para extração de substâncias pécticas foi seco em estufa a 45ºC durante 24 horas e, posteriormente, triturado com auxílio do moinho para obtenção de um pó de fina granulação. O pó (farinha) foi armazenado em embalagem de vidro hermeticamente fechado e estocado ao abrigo de luz e umidade para posteriormente ser utilizado como matéria-prima para extração de substâncias pécticas .

Caracterização físico-química da farinha (pó) do mesocarpo de P. nitida
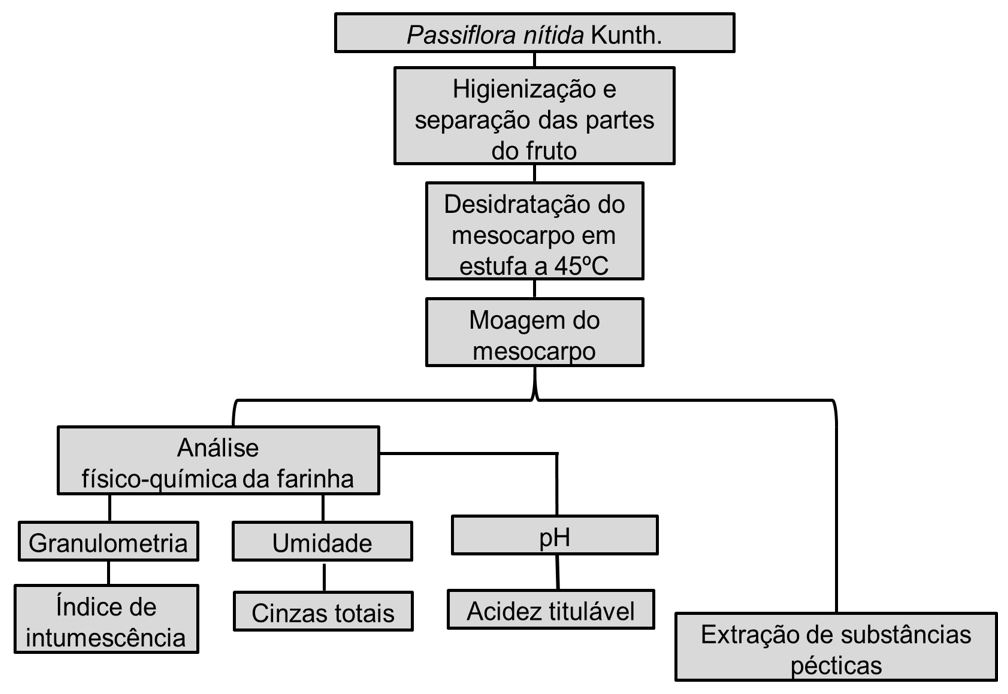
O fluxograma (FIGURA 2) resume as etapas de caracterização da farinha e extração de substâncias pécticas de P. nitida. Os experimentos foram realizados em triplicata.
Determinação granulométrica
A análise granulométrica da farinha do mesocarpo de P. nitida foi realizada de acordo com metodologia descrita na Farmacopeia[34], com adaptações. Foram utilizados 5 g da farinha, dividida em tamises de aberturas nominais de 250,180, 125 e 75 μm de diâmetro, com vibração 7 por um período de 15 minutos.
As amostras retidas nas malhas dos tamises foram pesadas com o auxílio de uma balança analítica de precisão, e em seguida, foi realizada a determinação do tamanho das partículas e do percentual de pó retido nos tamises de acordo com a equação abaixo:
% Retida pelo tamis = P1P2.100
Onde, P1 é o peso da amostra retida em cada tamis (em gramas); P2 é a soma dos pesos retidos em cada tamis e no coletor (em gramas) e 100 é fator de porcentagem.
Determinação do índice de intumescência
A determinação do índice de intumescência foi realizada segundo metodologia descrita na Farmacopeia[34]. Foi utilizado 1 g de farinha em provetas de 25 mL, com adição de água ultrapura mantidos sob agitação a cada 10 minutos por uma hora. As amostras foram deixadas em repouso por 3 horas à temperatura ambiente. Posteriormente, foram verificados os volumes finais ocupados pelas amostras, onde o Índice de intumescência (Ii) foi calculado em mililitros, pela média de 3 determinações segundo a equação abaixo:
Ii = Vf-Vi
Onde, Vf corresponde ao volume final ocupado pela amostra (mL); Vi é o volume inicial ocupado pela amostra (mL).
Determinação de acidez titulável
A determinação da acidez titulável foi realizada segundo metodologia descrita pelo Instituto Adolf Lutz[35]. A acidez foi obtida por titulometria com solução padronizada de hidróxido de sódio a 0,1 N, possuindo como indicador a fenolftaleína. Os valores foram expressos em porcentagem de acordo com a equação abaixo:
V x F x 10P
Onde, V é número de mL da solução de hidróxido de sódio 0,1 N gasto na titulação; F é fator de correção da solução de hidróxido de sódio 0,1 N; P é número de g da amostra.
Determinação de umidade
Para a determinação de umidade da farinha foi realizado o método gravimétrico descrito na Farmacopeia Brasileira[34]. Os cadinhos foram previamente dessecados a 105ºC durante 1 hora. Em seguida, os cadinhos foram resfriados em dessecador por 30 minutos e pesados. Posteriormente, foi pesado 2 g da farinha e levado à estufa a 105ºC, após 2 horas sendo monitorados até peso constante. O percentual da perda por dessecação foi calculado pela equação abaixo:
% Umidade = Pu - PsPa x 100
Onde, Pa corresponde ao peso da amostra; Pu é o peso do cadinho contendo a amostra antes da dessecação; Ps é peso do cadinho contendo a amostra após a dessecação.
Determinação de cinzas totais da farinha
A análise de cinzas totais da farinha foi realizada conforme descrição na Farmacopeia[34]. Foram pesadas 3 g da farinha e em seguida transferidos para cadinhos de porcelana previamente calcinados, arrefecidos e pesados. As amostras foram uniformemente distribuídas e incineradas em mufla, aumentando gradativamente (30 minutos a 200ºC, 60 minutos a 400ºC e 90 minutos a 600ºC), até 600 ± 25 ºC durante 3 horas. Os cadinhos foram resfriados em dessecador e pesados em seguida. A porcentagem de cinzas foi calculada em relação à farinha seca ao ar, segundo a equação abaixo:
% Cinzas totais = (P1 - P3)P2 x 100
Onde, P1 corresponde ao peso do cadinho contendo a amostra antes da calcinação; P3 é peso do cadinho contendo a amostra após a calcinação; P2 é o peso da amostra inicial; 100 é fator de porcentagem.
Extração de substâncias pécticas
As substâncias pécticas da farinha do mesocarpo de P. nitida foram extraídas de acordo com metodologia descrita por Munhoz et al.[36], com adaptações. Amostras da farinha (4 g) foram dissolvidas em 200 mL de água destilada. As amostras foram separadas em 2 grupos: grupo 1 foi utilizado ácido L-ascórbico P.A. (marca NEON) a 5% e no grupo 2, suco de limão da fruta in natura a 5%, ambos usando a temperatura de 60ºC por 120 minutos e 80ºC por 60 minutos. Após extração ácida, as amostras foram resfriadas a 4 ºC por uma hora, filtradas em tecido poliéster, com descarte da parte sólida. Ao filtrado foi adicionado álcool etílico (92%) na proporção 1:2 (v/v). Após uma hora, houve a precipitação das substâncias pécticas, separadas por filtração, em seguida levadas para estufa a 55ºC até peso constante. O rendimento de substâncias pécticas foi determinado de acordo com a equação abaixo:
Rendimento = Substâncias pécticas extraidas x 100Massa farinha (seca)
Análise Estatística
Os dados foram submetidos à análise de variância (ANOVA) utilizando o programa Past (versão 3.26).
Resultados e Discussão
Caracterização físico-química da farinha de mesocarpo de P. nitida
Como pode ser observado na (TABELA 1) o epicarpo e mesocarpo obtidos de P. nitida representam mais de 50% do peso total do fruto. Este é um fruto comercializado e consumido na sua forma in natura, resultando no desperdício da casca e mesocarpo. O Brasil apresenta uma expressiva demanda de cultivo e processamento de frutos, sendo caracterizado como um dos países latinos mais predispostos ao desperdício[15]. Como resultado da alta demanda na produção surge problemas de geração de resíduos e sua destinação inadequada, apontando a importância do incentivo no desenvolvimento de pesquisas, que identifiquem soluções viáveis para o reaproveitamento desses resíduos como matéria prima para o desenvolvimento de subprodutos[15].
| Passiflora nitida | Componente (%) |
| Epicarpo | 21,8 |
| Mesocarpo | 31,7 |
| Polpa (com sementes) | 46,5 |
Na TABELA 2 estão os dados da caracterização físico-química da farinha obtida do mesocarpo. A farinha produzida do mesocarpo de P. nitida foi classificada como pó semifino, definido como aquele cujas partículas passam no máximo 40% pelo tamis com abertura nominal de malha de 180 µm[34]. A granulometria refere-se ao grau de divisão de pós-expresso em relação à abertura nominal da malha dos tamises utilizados[34]. Esta constitui um aspecto de qualidade importante na padronização de farinhas, a uniformidade o tamanho dos grânulos influência na capacidade de absorção de solventes, na dispersibilidade das partículas e no tempo de extração das substâncias pécticas, interferindo diretamente no rendimento final do produto[38,39].
O índice de intumescência da farinha do mesocarpo de P. nitida foi de 2,6 mL ± 0,5. Este parâmetro é definido como a medida de volume ocupado pelo intumescimento de 1 g da farinha devido à adição de água como agente intumescente[32]. O índice de intumescência pode indicar a presença de substâncias pécticas que possuem propriedades de absorção de água. Quando em contato com o solvente resultam no aumento de volume do material que as contenha, tratando-se de um parâmetro importante em processos extrativos, auxiliando na determinação do volume de água a ser adicionado durante a extração de substâncias pécticas[40].
Como pode ser observado na TABELA 2, o índice de acidez da farinha do mesocarpo de P. nitida foi de 3,5 ± 0,1 com pH de 4,1. Marchi et al. [41], obtiveram valores de acidez titulável para cascas de P. edulis (maracujá amarelo) que variaram de 3,91 - 4,68%. A acidez constitui um parâmetro importante na conservação visto que a acidificação desempenha uma função inibidora no crescimento microbiano[42].
O valor obtido quanto a umidade da farinha de P. nitida adequa-se ao estabelecido pela Agência Nacional de Vigilância (ANVISA) que estipula o máximo de 15% para umidade de farinhas vegetais[43]. É importante salientar, que a presença de quantidade excessiva de água em farinhas poderá propiciar o desenvolvimento de microrganismos, insetos, a hidrólise e a atividade enzimática com consequente deterioração dos constituintes da amostra analisada[44]. O processo de secagem foi realizado até peso constante em temperatura de 105ºC, com obtenção de uma farinha estável.
O teor cinza para a farinha do mesocarpo de P. nitida foi de 3,3% ± 0,3. Resultados semelhantes foram obtidos no estudo realizado com o mesocarpo in natura de P. nítida de 3,1% [33]. As cinzas indicam substâncias inorgânicas não voláteis que poderiam estar presentes como constituintes ou contaminantes da amostra[45]. É importante salientar que no preparo da farinha foram obedecidas as boas práticas de produção.
| Características | Farinha |
| Granulometria (%) | Semifino (32,02 ± 0,1) |
| Índice de intumescência (mL) | 2,6 ± 0,5 |
| Acidez total titulável (%) | 3,5 ± 0,1 |
| pH | 4,1 |
| Umidade (%) | 10,8 ± 0,1 |
| Cinzas (%) | 3,3 ± 0,3 |
Os resultados obtidos neste estudo podem ser apresentados como características de qualidade de uma farinha do mesocarpo de P. nitida, uma vez que, não há parâmetros descritos para esta matéria prima vegetal.
Extração de substâncias pécticas
Na TABELA 3 estão os dados de rendimento de substâncias pécticas obtidos da farinha do mesocarpo de P. nitida por extração ácida. Como pode ser observado, embora o suco de limão obtido do fruto in natura tenha apresentado maior teor de substâncias pécticas em comparação ao ácido L-ascórbico, torna-se necessário a padronização do suco para sua possível aplicabilidade no processo industrial, uma vez que, dependendo da variedade do limão os índices de acidez e brix poderão variar. No entanto, essa alternativa não deve ser descartada, sendo que, este é de fácil aquisição e poderá diminuir os custos da produção após a sua padronização.
Vale destacar que estes dados são preliminares, devido não ter sido realizada a avaliação do grau de metoxilação (DM) das substâncias encontradas. Este parâmetro determina a proporção de grupos carboxílicos que estão presentes na forma esterificada, possibilitando mensurar o grau e velocidade de gelificação das substâncias pécticas. Porém, por meio da análise em álcool a 96 ºGL, foi observado que as substâncias pécticas extraídas tanto usando suco de limão in natura, quanto ácido L-ascórbico, apresentaram uma gelificação rápida e firme, o que indica substâncias pécticas com alto grau de metoxilação. Substâncias pécticas com DM maior que 60% de esterificação, apresentam maior rapidez na gelificação sob temperaturas mais altas[46].
A busca de um método adequado para extração de substâncias pécticas é importante na otimização de métodos para sua obtenção, com intuito de minimizar a degradação da molécula, maximizar o rendimento da extração e manter a qualidade do produto. Segundo Pagan et al.[47] e Oliveira[14], tempos relativamente longos podem interferir no processo de extração com a degradação das substâncias pécticas com alterações indesejáveis nas suas propriedades físico-químicas e tecnológicas e, consequentemente, a diminuição da quantidade a ser precipitada com o álcool, devido a construção de um gel fraco, o que ocasiona redução no rendimento final.
As substâncias pécticas são geralmente extraídas em pH variando de 1 a 3 e em temperaturas de 80ºC a 100ºC[47]. Alguns autores como Mesbahi, et al.[48] relataram que temperaturas acima de 90ºC podem provocar a hidrólise e degradação das substâncias pécticas, resultando em uma molécula de baixa massa molar.
Para a extração de substâncias pécticas é necessário abordar processos que não geram resíduos poluentes, apresentam bons rendimentos de extração e não alteram a estrutura química do produto final. Normalmente as substâncias pécticas são obtidas na extração com diversos ácidos fortes (tartárico[49], nítrico[6], clorídrico[48], entre outros) apresentando desvantagens por gerarem resíduos tóxicos. Estudos têm apresentado o ácido cítrico como alternativa na extração de substâncias pécticas, como forma de minimizar a geração de resíduos poluentes e melhorar a qualidade[23,49].
Com relação a escolha da concentração de ácido utilizado nas extrações de substâncias pécticas, estudos demonstram que substâncias pécticas extraídas com frações maiores de ácido, podem acarretar ligação do ácido cítrico a estrutura péctica, consequentemente na formação de outros compostos, ou ainda, podem favorecer a degradação das moléculas[16,47,50]. No estudo com goiaba desidratada, Munhoz et al.[22] utilizaram concentrações de ácido cítrico que variavam entre 5 - 7%, apresentando melhores rendimentos de pectina nas extrações a 5% de ácido cítrico durante o período de 60 minutos.
| Rendimento Médio da Pectina (temperatura/tempo) | |||
| Tratamento | pH | 60ºC/120 min (%) | 80ºC/60 min (%) |
| Ácido L-ascórbico | 2,6 | 12,2 ± 0,3 | 12,9 ± 0,3 |
| Suco de Limão in natura | 2,1 | 14,3 ± 0,2 | 17,9 ± 0,3 |
O rendimento de substâncias pécticas extraída do mesocarpo de P.nitida apresentou valor dentro da faixa de subprodutos utilizados nas agroindústrias ricas nessas substâncias com teor superior a 15% em base seca[8]. Em estudo de Pinheiro[23] com pectina extraída da casca de P. edulis a 0,086% de ácido cítrico e tempo de extração 60 minutos a 97ºC, obtendo rendimento de 27,4%. Canteri-Schemin et al.[49] extraíram e caracterizaram pectina de bagaço de maçã definindo o melhor rendimento de17,82%, obtido com ácido cítrico a 6,2% a 100ºC por 153 minutos. Munhoz[36] realizou a extração de pectina da farinha da polpa e da polpa com casca de goiaba (Psidium guajava L.), com concentrações de ácido cítrico de 5% a 7%, a 97ºC durante 25 a 60 minutos, com rendimentos que variaram de 7,31% a 13,66%.
Apesar dos resultados obtidos neste estudo apresentarem semelhanças com os encontrados na literatura, é necessário a realização de análises cromatográficas para garantir que os teores de substâncias pécticas não correspondam a mucilagens, hemicelulose ou outros compostos.
Conclusão
O mesocarpo de P. nitida poderá ser uma fonte para obtenção de substâncias pécticas, visto, ser um produto de descarte no consumo do fruto in natura. Como o cultivo na região amazônica está crescendo, futuramente sua polpa poderá ser amplamente consumida, gerando assim descartes que poderão ser aproveitados na produção de pectinas e seus subprodutos. Os resultados são promissores o que estimula a continuidade dos estudos no sentido de caracterização das substâncias pécticas e sua possível aplicabilidade nos diferentes segmentos das indústrias.
Agradecimentos
À Faculdade e ao Curso de Odontologia do Centro Universitário de Volta Redonda- UniFOA, pela colaboração e parceria com seus egressos, além de darem oportunidade, estrutura e suporte necessários para a realização de pesquisas e trabalhos como o realizado acima. Aos professores que disponibilizaram tempo e conhecimento para obtermos dados satisfatórios e que desde o início se fizeram presentes, dando o melhor de si para nos ajudar. Aos funcionários que participaram da pesquisa colaborando com disposição para obtenção dos resultados.
Referências
1. Voragen AGJ, Coenen GJ, Verhoef RP, Schols HA. Pectin, a versatile polysaccharide present in plant cell walls. Struct Chem. 2009; 20(2): 263–75. ISSN 1572-9001. [CrossRef].
2. Gummadi SN, Panda T. Purification and biochemical properties of microbial pectinases-a review. Proc Biochem. 2003; 38(7): 987-996. ISSN 1359-5113. [CrossRef].
3. Ridley BL, O'Neill MA, Mohnen D. Pectins: Structure, biosynthesis, and oligogalacturonide-related signaling. Phytochemistry. 2001; 57(6): 929-967. ISSN 0031-9422. [PubMed] [CrossRef].
4. Willats WGT, Knox P, Mikkelsen, JD. Pectin: New insights into an old polymer are starting to gel. Trends in Food Sci Technol. 2006; 17(3): 97-104. ISSN 0924-2244. [CrossRef].
5. Willats WGT, McCartney L, Mackie W, Knox JP. Pectin: cell biology and prospects for functional analysis. Plant Mol Biol. 2001; 47 (1-2): 9-27. [PubMed] [CrossRef].
6. Lévigne S, Ralet MC, Thibault JF. Characterisation of pectins extracted from fresh sugar beet under different conditions using an experimental design. Carbohyd Polym. 2002; 19: 145-153. ISSN 0144-8617. [CrossRef].
7. Yapo BM, Robert C, Etienne I; Wathelet B, Paquot M. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pulp pectin extracts. Food Chem. 2007; 100(4): 1356-1364. ISSN 0308-8146. [CrossRef].
8. Canteri MHG, Moreno L, Wosiacki G, Scheer AP. Pectina: da matéria-prima ao produto final. Polímeros. 2012, 22(2): 149-157. ISSN 0104-1428. [CrossRef]
9. Sriamornsak P. Chemistry of pectin and its pharmaceutical uses: a review. Silpakorn Univ Inter J Bangkok. 2003; 3: 206–228. [Link].
10. Piedade J, Canniatti-Brazaca SG. Comparação entre o efeito do resíduo do abacaxizeiro (caules e folhas) e da pectina cítrica de alta metoxilação no nível de colesterol sanguíneo em ratos. Ciên Tecnol Alim. 2003; 23 (2):149-156. [CrossRef].
11. Hur SJ, Kim YC, Choi I, Lee SK. The effects of biopolymer encapsulation on total lipids and cholesterol in egg yolk during in vitro human digestion. Inter J Mol Sci. 2013; 14(8): 16333-16347. [Link].
12. Vandamme TF, Lenourismo A, Charrueau C, Chaumeil J-C. The use of polysaccharides to target drugs to the colon. Carbohyd Polym. 2002; 48: 219-231. [CrossRef].
13. Souto-Maior JPA, Reis AV, Pedreiro LN, Cavalcanti OA. Avaliação da pectina fosfatada aplicada na formação de filmes isolados. Material candidato a novos sistemas para liberação modificada de fármacos. Rev Bras Cien Farm J Pharm Sci. 2008; 44(2): 203-213. [CrossRef].
14. Oliveira CF. Aplicação de diferentes tecnologias na extração de pectina presente na casca do maracujá. Porto Alegre. 2015. 161fs. Tese de Doutorado [Programa de Pós-graduação em Engenharia Química], Departamento de Engenharia Química, Universidade Federal do Rio Grande do Sul. [Link].
15. Oliveira L, Nascimento MRF, Borges SV, Ribeiro PCN, Ruback VR. Aproveitamento alternativo da casca do maracujá-amarelo (Passiflora edulis F. Flavicarpa) para produção de doce em calda. Ciên Tecnol Aliment. 2002; 22(3): 259-62. ISSN 0101-2061. [CrossRef].
16. Fertonani HCR, Scabio A, Canteri MH, Carneiro EBB, Nogueira A, Wosiacki G. Influência da concentração de ácidos no processo de extração e na qualidade de pectina de bagaço de maçã. Semin Ciên Agr. Londrina. 2006; 27(4): 599-612. [CrossRef].
17. Gerhardt C, Wiest JM, Girolometto G, Silva MAS da, Weschenfelder S. Aproveitamento da casca de citros na perspectiva de alimentos: prospecção da atividade antibacteriana. 4º Simpósio de Segurança Alimentar. FAURGS, Gramado. RS. Braz J Food Technol. 2012; 15(sup.): 11-17. [Link].
18. Calliari CM. Extração térmica, química e enzimática de pectina de bagaço de laranja. Londrina. 2004. 90fls. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências de Alimentos] - Universidade Estadual de Londrina. [Link].
19. Iglesias MT, Lozano JE. Extraction and characterization of sunflower pectin. J Food Eng. 2004. 62(3): 215-223. [CrossRef].
20. Oliveira AN. Pectinas de casca de manga (Mangífera Índica l.) cv. Ubá: otimização da extração, caracterização físico-química e avaliação das propriedades espessantes e gelificantes. Minas Gerais. 2013. 174fls. Tese de Doutorado [Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos] - Universidade Federal de Viçosa. [Link].
21. Rebello LPG. Avaliação de compostos fenólicos, extração e caracterização de pectina em farinha de casca de banana (musa aaa). Minas Gerais. 2013. 105fls. Tese de Doutorado [Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos] - Universidade Federal de Viçosa. [Link].
22. Munhoz CL. Efeito das condições de extração sobre rendimento e características da pectina obtida de diferentes frações de goiaba CV Pedro Sato. 2008. 59fls. Goiânia. Dissertação de Mestrado [Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos] – Universidade Federal de Goiás. [Link].
23. Pinheiro ER. Pectina da casca do maracujá amarelo (Passiflora edulis flavicarpa): otimização da extração com ácido cítrico e caracterização físico-química. 2007. 79fls. Florianópolis. Dissertação de Mestrado [Programa de Pós-Graduação em Ciência dos Alimentos] - Universidade Federal de Santa Catarina. [Link].
24. Kliemann E. Extração e caracterização da pectina da casca do maracujá amarelo (Passiflora edulis flavicarpa). 2006. 77fls. Florianópolis. Dissertação de Mestrado [Programa de Pós-Graduação em Ciência dos Alimentos] – Universidade Federal de Santa Catarina. [Link].
25. Casagrande J, Machado ATP, Silva M, Canteri MHG. Extraction, characterization and partial purification of the pectin lyase from passiflora edulis f. flavicarpa O. Deg mesocarp. Rev Virtual Quim. 2017; 9(6): 2214–25. ISSN 19846835. [Link].
26. Canteri MHG. Caracterização comparativa entre pectinas extraídas do pericarpo de maracujá-amarelo (Passiflora edulis f. flavicarpa). 2010. 163fls. Curitiba. Tese de Doutorado [Programa de Pós-Graduação em Tecnologia de Alimentos] – Universidade Federal do Paraná. [Link].
27. Reflora. Flora do Brasil 2020 em construção. Passiflora nitida Kunth. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. COPPETEC-UFRJ. [acesso em 22 nov. 2019]. [Link].
28. Junqueira KP, Faleiro FG, Ramos JD, Bellon G, Junqueira NTV, Braga MF. Variabilidade genética de acessos de maracujá-suspiro com base em marcadores moleculares. Rev Bras Frutic. 2007; 29(3): 571-575. ISSN 1806-9967. [CrossRef].
29. Moraes MC, Vieira MLC, Novaes QS, Rezende JAM. Susceptibilidade de Passiflora nitida ao Passion fruit woodiness virus. Fitopatol Bras. 2002; 27(1): 108-108. ISSN 1678-4677 [CrossRef].
30. Carvalho MJ, Nascimento PT, Guilhon-Simplicio F, Nunez CV, Ohana DT, Meneses PM et al. Estudo farmacognóstico e atividade in vitro sobre a coagulação sanguínea e agregação plaquetária das folhas de Passiflora nitida Kunth (Passifloraceae). Acta Amaz. 2010; 40(1): 199-205. ISSN 0044-5967. [CrossRef].
31. Hopkins MJG, Vicentini A, Sothers CA, Costa MAS, Brito JM, Souza MAD et al. Flora da Reserva Ducke: guia de identificação das plantas vasculares de uma floresta de terra-firme na Amazônia Central. Manaus. Instituto Nacional de Pesquisas da Amazônia; 1999; 299p. ISBN 180531.
32. Bendini A, Cerretani L, Pizzolante L, Toschi TG, Guzzo F, Ceoldo S et al. Phenol content related to antioxidant and antimicrobial activities of Passiflora spp. extracts. Eur Food Res Technol. 2006; 223(1): 102-109. ISSN 1438-2385. [CrossRef].
33. Lima ES, Schwertz MC, Sobreira CRC, Borras MRL. Efeito hipoglicemiante da farinha do fruto de maracujá-do-mato (Passiflora nitida Kunth) em ratos normais e diabéticos. Rev Bras Plantas Med. 2012; 14(2): 383-388. ISSN 1516-0572. [CrossRef].
34. Brasil. Farmacopeia Brasileira. 5ª ed. Brasília: Agência Nacional de Vigilância Sanitária, 2010. 545. [Link].
35. Instituto Adolfo Lutz. Métodos físico-químicos para análises de alimentos. Normas Analíticas do Instituto Adolfo Lutz. 4ª ed. 2008; 1000. [Link].
36. Munhoz CL, Sanjinez-Argandoña EJ, Soares-Júnior MS. Extração de pectina de goiaba desidratada. Cien Tecnol Aliment. 2010; 30(1). ISSN 0101-2061. [CrossRef].
37. Dias LT, Leonel M. Caracterização físico-química de farinhas de mandioca de diferentes localidades do Brasil. Ciên Agrotec. 2006; 30(4): 692-700. ISSN 1981-1829. [CrossRef].
38. Guerreiro L. Massa Alimentícias. Dossiê Técnico: Serviço Brasileiro de Respostas Técnicas – SBRT. 2006; 40. [Link].
39. Gomes Neto JNF. Avaliação do potencial terapêutico da farinha da casca de Passiflora edulis nas dislipidemias e diabetes induzidas. 2009. 112fls. Fortaleza. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Universidade Federal do Ceará. [Link].
40. WHO. Quality control methods for herbal materials. World Health Organization, Geneve. 2011; 173. ISBN: 9789241500739. [Link].
41. Marchi R, Monteiro M, Benato EA, Silva CAR. Uso da cor da casca como indicador de qualidade do maracujá amarelo (Passiflora edulis Sims. f. flavicarpa Deg.) destinado à industrialização. Ciên Tecn Aliment. 2000, 20 (3); 381-387. ISSN 01012061. [CrossRef]
42. Jay JM. Microbiologia de Alimentos. 6ª ed. São Paulo: Artmed, 2005. 712p. ISBN: 9788536305073. [ Link].
43. Brasil. Comissão Nacional de Normas e Padrões para Alimentos CNNPA. Normas Técnicas Especiais. Resolução CNNPA nº 12, de 27 de julho de 1978. Brasília, 1978. [Link].
44. Amaral FMM, Coutinho DF, Ribeiro MNS, Oliveira MA. Avaliação da qualidade de drogas vegetais comercializadas em São Luís/Maranhão. Rev Bras Farmacogn. 2003; 13(supl.1): 27-30. ISSN 0102-695X. [CrossRef].
45. Couto RO, Valgas AB, Bara MTF, Paula JR. Caracterização físico-química do pó das folhas de Eugenia dysenterica DC. (Myrtaceae). Rev Eletr Farm. 2009; 6(3): 59-69. [CrossRef].
46. Brandão EM, Andrade CT. Influência de fatores estruturais no processo de geleificante de pectinas de alto grau de metoxilação. Polímeros. 1999; 9(3): 38-44. ISSN 0104-1428. [CrossRef].
47. Pagan J, Ibarz A, Llorca M, Pagan A, Barbosa-Canovas GV, Extraction and characterization of pectin from stored peach pomace. Food Res. 2001; 34(7): 605–612. [CrossRef].
48. Mesbahi G, Jamalian J, Farahnaky A. A comparative study on functional properties of beet and citrus pectins in foods systems. Food Hydr. 2005; 19(4): 731-738. ISSN 0268-005X. [CrossRef].
49. Canteri-Schemin MH, Fertonani HCR, Waszczynskyj N, Wosiacki G. Extraction of pectin from Apple pomace. Braz Arch Biol Technol. 2005; 48 (2): 259-266. [CrossRef].
50. Kalapathy U, Proctor A. Effect of acid extraction and alcohol precipitation conditions on the yeld and purity of soy hull pectin. Food Chem. 2001; 73 (4): 393-396. [CrossRef].