Artigo de Pesquisa
Discussão sobre o acesso aos medicamentos derivados da Cannabis à luz da Inovação em Saúde no Brasil
Discussion on access to Cannabis-derived drugs in the light of Health Innovation in Brazil
Resumo
A discussão sobre o acesso aos medicamentos derivados da Cannabis, à luz da Inovação em Saúde no Brasil se enquadra como um estudo de caso, construído através de molduras narrativas. A narrativa sobre a Inovação em Saúde descreve conceitos teóricos de uma vertente evolucionária da economia e a elaboração de um Sistema Nacional de Inovação em Saúde na perspectiva do Complexo Econômico Industrial da Saúde. A Pesquisa do uso Medicinal da Cannabis revela a contribuição da ciência abrindo caminho para a inovação. Um histórico sobre a Judicialização e Regulação como via de acesso aos medicamentos no Brasil, demonstra que as decisões judiciais podem comprometer o orçamento para a realização das políticas de saúde pública. Registra ainda a publicação, em 2019, da RDC 327 da Anvisa, que dispõe sobre a fabricação e importação de produtos da Cannabis no Brasil, sem resolver o acesso a tais medicamentos. Uma discussão apresentada sob um novo prisma sinaliza as Parcerias de Desenvolvimento Produtivo (PDPs) como uma alternativa para a produção nacional dos medicamentos da Cannabis ampliando o acesso aos mesmos. Este estudo conclui que novas medidas regulatórias serão necessárias, além do reconhecimento dos medicamentos da Cannabis como estratégicos para o Sistema Único de Saúde.
- Palavras-chave:
- Inovação e Saúde.
- Acesso.
- Medicamentos da Cannabis sp.
Abstract
The discussion on access to Cannabis-derived drugs, in the light of Health Innovation in Brazil, corresponds to a case study, constructed through narratives frames. The narrative of Health Innovation describes theoretical concepts of an evolutionary aspect of the economy and the elaboration of a National Health Innovation System from the perspective of the Health Industrial Economic Complex. The Research on the Medical Use of Cannabis reveals the contribution of science by opening the path to innovation. The history of Judicialization and Regulation as a means of access to medicines in Brazil, shows that judicial decisions can deter the public health policies implementation budget. It also registers the RDC 327, 2019 publication from Anvisa, providing rules for manufacturing and importing of Cannabis products in Brazil, without solving the access to these drugs. A discussion in a new perspective indicates that Productive Development Partnerships (PDPs) as an alternative to the national production of Cannabis drugs, expanding access to them. This study concludes that new regulatory measures are necessary, in addition to the recognition of Cannabis drugs as strategic for the Unified Health System.
- Keywords:
- Innovation and Health.
- Access.
- Cannabis sp. drugs.
Introdução
A partir dos anos de 1990, a inovação passa a ser chave para o desenvolvimento no mundo, pondo abaixo a crença de que o desenvolvimento tecnológico viria a reboque do desenvolvimento econômico e não como seu pré-requisito. Durante a década seguinte é possível verificar no Brasil um esforço de alinhamento internacional no que diz respeito à formulação de políticas de ciência, tecnologia e inovação. Neste cenário, destacam-se aquelas relacionadas à Inovação em Saúde, visando, de uma forma geral o bem estar social, considerando ainda a ampliação do acesso aos bens e produtos resultantes do processo inovativo. Também é de conhecimento público a divulgação dos resultados de diversas pesquisas científicas sobre o uso medicinal da Cannabis L. (Cannabaceae), abrindo o caminho para seu desenvolvimento tecnológico e inovação.
O uso medicinal das espécies de Cannabis (Cannabis sp.) é milenar, tendo sido descrito por Discórides ainda no Século I. No Brasil, sua ação farmacológica é descrita nos compêndios médicos e catálogos da década de 1930 como hipnótico, sedativo, calmante, usado em nevralgias, insônia, dispepsias e como tal foi utilizada até o momento em que a planta foi criminalizada pelo artigo 281 do Código Penal de 1940[1,2]. As décadas que sucederam os anos de 1950 registraram dois grandes debates relacionados à Cannabis sp. no mundo: a sua descriminalização e seu uso medicinal.
No Brasil, a discussão sobre o acesso aos medicamentos à base de canabinóides tem sido pautada tanto no campo do Direito quanto no campo da Regulação, carecendo, entretanto, de uma análise dos impactos que as políticas de Inovação em Saúde elaboradas nas duas últimas décadas teriam sobre o mesmo.
Sem a pretensão de esgotar o tema, esta pesquisa visa promover a discussão sobre a ampliação do acesso aos medicamentos derivados da Cannabis à luz das premissas da Inovação em Saúde no Brasil. O presente trabalho apresenta nas 3 primeiras seções as narrativas Inovação em Saúde no Brasil, Pesquisa do Uso Medicinal da Cannabis sp., e Judicialização e Regulação no acesso a medicamentos, para então discutir o acesso sob um novo prisma e apresentar suas conclusões.
Material e Métodos
Nesta pesquisa leva-se em consideração o fato de que as políticas públicas atualmente têm sido estudadas como um processo de argumentação onde o problema a ser abordado é construído através de molduras conceituais que estruturam a ação política. Tais molduras constituem os princípios da organização de significados subjetivos atribuídos, transformando informações fragmentadas em um todo estruturado[3]. Desta forma, foram elaboradas molduras que permitissem a discussão sobre o acesso aos medicamentos derivados da Cannabis à luz da Inovação em Saúde no Brasil compondo as seções: Inovação em Saúde no Brasil, Pesquisa do Uso Medicinal da Cannabis sp., e Judicialização e Regulação no acesso a medicamentos, estruturando desta forma, a discussão do objeto desta pesquisa.
Os levantamentos foram realizados nas bases de dados PUBMED/MEDLINE, LILACS, SCIELO, COCHRANE LIBRARY e GOOGLE, nos idiomas inglês, português e espanhol, abrangendo o período entre 1960 até 2019. Foram feitas, também, consultas no acervo legislativo na base dados da Agência Nacional de Vigilância Sanitária (ANVISA) no período supracitado.
Observa-se que, para a seção Pesquisa do uso medicinal da Cannabis sp. foram realizadas três pesquisas distintas, para organização desta moldura:
- descriminalização e uso medicinal da Cannabis sp.;
- atividade farmacológica das dez classes principais de fitocanabinoides e;
- estudos dos extratos brutos e soluções contendo Cannabis sp. ou seus derivados como o canabidiol (CBD) e tetrahidrocanabinol (THC).
Inovação em Saúde no Brasil
As políticas relacionadas à Inovação e Saúde no Brasil compõem esta narrativa, que aborda inicialmente a emergência de novos conceitos e teorias no âmbito das políticas de ciência, tecnologia e inovação no mundo[4]. Durante a década de 1990, o poder transformador das tecnologias e inovações na economia e sociedade já se fazia presente nas estratégias internacionais, regionais e nacionais do mundo considerado desenvolvido, como descrito em trabalho organizado por Lundvall e Borrás[5]. Tais autores abordam, entre outras, questões como: qual o impacto para políticas de inovação resultantes da emergência de uma economia global; quais efeitos da globalização nos sistemas nacionais de inovação e que mecanismos permitiriam um desenho mais apropriado para as políticas de pesquisa e desenvolvimento. Os conceitos relacionados aos Sistemas Nacionais de Inovação, Economia baseada no Conhecimento e Economia da Informação haviam sido assumidos no âmbito da Organização para a Cooperação e Desenvolvimento Econômico (OCDE), atrelando a inovação ao desenvolvimento econômico. A OCDE que desempenha um papel específico como fonte de ideias para os formuladores de políticas nacionais, pode ser entendida como um grupo de reflexão orientado pela pesquisa que elabora bases conceituais e teóricas apresentadas para os países membros para que os mesmos possam aprimorar sua compreensão e lidar com os problemas inerentes as políticas de Ciência, Tecnologia e Inovação (CTI). Da mesma forma é utilizada pela maioria dos grupos ou organizações protagonistas na história da política de CTI, tais como o National Bureau of Economic Research, dos EUA (NBER), a RAND Corporation e a British Science Policy Research Unit (SPRU), a OCDE facilita a análise de políticas através do uso de metáforas como Economia do Conhecimento, Economia do Conhecimento e Informação, Sociedade do Conhecimento e Informação e assim por diante, dando significado ao seu conteúdo. A estrutura teórico-conceitual, para a discussão e entendimento das características deste novo padrão mundial, foi elaborada através de extensa contribuição de autores tanto em trabalhos independentes ou ligados a instituições de ensino e pesquisa, quanto em fóruns e instituições governamentais nacionais e internacionais. No Brasil, diversos trabalhos descrevem a Economia da Informação Conhecimento e Aprendizado como uma escola construída a partir de conceitos teóricos da informação, conhecimento e aprendizado com a missão de explicar o desenvolvimento econômico no mundo contemporâneo[6-8]. Esta escola se identifica com uma economia heterodoxa, evolucionária, neo-schumpeterina, que aborda uma era de transição entre paradigmas Tecno-econômicos, sujeita a transformações radicais e envolvendo tecnologias e atividades intensivas em informação, onde a simbiose com processos de acumulação de aprendizado e conhecimento é absolutamente indispensável. Programas de pesquisa envolvendo, economistas e sociólogos e diversos outros profissionais, foram conduzidos para sistematizar a base teórica para formulação de políticas direcionadas para inovação, verificando uma forte correlação entre a capacidade ou habilidade de aprendizado e a ocorrência da inovação. A relação entre as pressões de transformação e a inovação, consideram as pressões de transformações inerentes a um dado Paradigma Tecno-econômico, onde as trajetórias tecnológicas são definidas por suas características originadas da oferta ou demanda de novas tecnologias, podendo desta forma, orientar a organização de Sistemas de Inovação com suas dimensões globais, regionais, nacionais e locais. Ainda na década de 1970, programas de pesquisa sobre a geração de conhecimento, motivaram novas publicações, como "The New Production of Knowledge"[9] elaborando o conceito do modo não linear de geração de conhecimento, denominado Modo 2 estabelecendo sua distinção ao Modo 1 (linear), considerado acadêmico. Seguindo esta nova perspectiva do conhecimento, o conhecimento tácito é descrito como aquele que não é passível de codificação, sendo o mesmo responsável pelo êxito ou é descrito não das transações de transferência de tecnologia. Por outro lado, a informação é descrita como conhecimento codificado.
Um marco evolucionário no campo da teoria econômica é exposto no trabalho de Nelson e Winter[10] expandindo o escopo e instrumentos de análise para lidar com a dinâmica evolutiva em economia, abandonando os pressupostos tradicionais de maximização e de equilíbrio, em benefício de comportamentos e estratégias mais realistas sob incerteza e racionalidade limitada, enfatizando a visão schumpeteriana da concorrência e da dinâmica da economia capitalista, onde as inovações são o princípio essencial. Desde o início dos anos de 1980, contribuições haviam sido oferecidas, por aqueles identificados com esta corrente da economia, para o entendimento do papel central que ocupam as inovações e suas bases de conhecimento na nova ordem mundial em conformação.
Resumidamente, a estrutura teórico-conceitual desta escola tem sua origem nas obras Teoria do Desenvolvimento Econômico e Capitalismo, Socialismo e Democracia de Joseph Schumpeter[11,12], ambas elaboradas ainda na primeira metade do século passado descrevendo a inovação assim como o papel central da firma no desenvolvimento econômico. A partir dos anos de 1980, seu caráter evolucionário distingue-se da ortodoxia neoclássica hegemônica, para se dedicar à análise da evolução e consequências sócio- econômicas do desenvolvimento da ciência e tecnologia a partir do trabalho An Evolutionary Theory of Economic Change de Nelson e Sidnei G.[13]. A teoria dos "Paradigmas Tecno-Econômicos" é elaborada por Dosi[14], constituindo um novo modelo analítico. A teoria dos "Sistemas Nacionais de Inovação" é descrita por Lundvall[15] e Freeman[16], demonstrando a forma pela qual a inovação tecnológica transforma o conhecimento em produtos, processos e serviços, fundamentais para o desenvolvimento sócio econômico dos países. Um sistema de inovação, nacional, regional ou local, pôde ser visto como uma rede de instituições públicas e privadas tais como, agências governamentais de fomento e financiamento, empresas públicas ou estatais, centros de Pesquisa e Desenvolvimento (P&D), universidades, associações empresariais, organizações não governamentais cujas atividades e interações geram, adotam, importam, modificam e difundem novas tecnologias, sendo a inovação e o aprendizado a base de sua estrutura. Lundvall distingue a informação do conhecimento estabelecendo uma forte correlação entre Aprendizado e Inovação[17]. Novas formas organizacionais são sugeridas para se lidar com a inovação no Paradigma Tecno-Econômico da Informação e respaldar a formulação e implantação de políticas públicas relacionadas à inovação. Esta estrutura teórico conceitual representa uma alternativa, em oposição aos conceitos neoclássicos, no que diz respeito a discussão surgida no final do milênio sobre um mundo integrado globalmente, uma vez que leva em consideração os aspectos históricos, geográficos, culturais, bem como a importância do conhecimento tácito no processo de inovação. Enfatiza o Conhecimento e Aprendizado e estabelece uma correlação entre a ocorrência da inovação e a habilidade no aprendizado, sendo esta fundamental para países regiões, locais, firmas e pessoas, especialmente para os países em desenvolvimento. Nesta perspectiva, os sistemas de inovação poderiam ser vistos como uma rede, sendo a inovação e o aprendizado suas características essenciais.
No Brasil, o intenso debate internacional teórico conceitual ocorrido a partir das décadas de 1980 e 1990, estabelecendo as bases para a formulação de políticas de CT&I no mundo globalizado, se refletiu em 2001 na realização da Conferência Nacional de Ciência, Tecnologia e Inovação[18]. Pela primeira vez centenas de instituições se reuniram para debater a importância do papel da inovação no universo da ciência e da tecnologia, se referindo à incorporação contínua do conhecimento nas atividades produtivas. Este evento elaborou os conceitos a serem incorporados pelo Sistema Nacional de Ciência e Tecnologia[19] resultando, em 2002, na publicação do Livro Branco[20] trazendo em seu objetivo o apontamento de caminhos para que Ciência, Tecnologia e Inovação (CT&I) contribuíssem de forma efetiva para a construção de um País mais dinâmico, competitivo e socialmente justo. Considerando os riscos e oportunidades associados às transformações econômicas e tecnológicas que marcam a sociedade contemporânea, o livro examina os principais desafios para a consolidação de um Sistema Nacional de Ciência, Tecnologia e Inovação, necessário para que o País pudesse criar condições de desenvolvimento sustentável, apresentando a proposta de Política de Ciência, Tecnologia e Inovação.
A partir do momento em que a inovação torna-se a chave para o desenvolvimento, pondo abaixo a crença que o desenvolvimento tecnológico viria a reboque do desenvolvimento econômico e não como seu pré-requisito, verifica-se o esforço de alinhamento internacional brasileiro diminuindo defasagens e abrindo uma nova fase para a formulação de políticas de ciência, tecnologia e Inovação no Brasil, inclusive aquelas relacionadas à inovação em saúde.
O limiar do século XXI coincidiu com o início de uma mudança, com um ponto de inflexão importante nas agendas estratégicas de ciência e tecnologia: a explicitação do componente inovação[21].
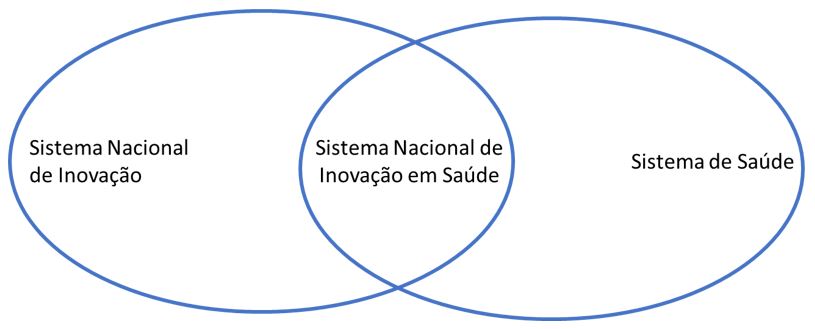
No campo da Inovação e Saúde a publicação do trabalho de Albuquerque e Cassiolato[19] descreveu o sistema de inovação biomédica, como uma interseção entre o Sistema Nacional de Inovação e o Sistema de Bem Estar. A dinâmica do setor saúde é exposta, em suas várias características, entre elas: a importância das universidades nas inovações biomédicas; a especificidade da atenção à saúde; instituições e a regulação dando a direção do desenvolvimento tecnológico, influenciando o desempenho econômico, industrial e social do setor saúde como um todo.
Em 2003, destacam-se publicações de relevância nesta narrativa. Reconhecendo a importância da geração e da difusão de inovações para o desenvolvimento socioeconômico nos países capitalistas além do caráter sistêmico, institucional e histórico desse processo, um estudo evidencia a necessidade de tratar a inovação em saúde considerando as dinâmicas que envolvem a economia, as instituições e as políticas públicas, demonstrando que nos países desenvolvidos, ao contrário do Brasil, existe uma compatibilidade entre as necessidades do sistema de saúde e do sistema de inovação, sendo o Estado um ator essencial na promoção dessa articulação[22].
Os autores postulam que as políticas de saúde, além de sua dimensão social, também constituem mecanismos estratégicos para a consolidação de um sistema de inovação dinâmico, com efeitos diretos no desenvolvimento nacional[23], conforme demonstra a FIGURA 1.
No mesmo ano, o Complexo Industrial da Saúde ganha um novo enfoque analítico na publicação de Gadelha[23] descrevendo o conjunto de atividades produtivas e suas relações de interdependência, apresentando uma alternativa ao paradigma neoclássico dominante. A interação entre o sistema de saúde e o sistema econômico industrial é analisada revelando que a dicotomia entre ambos, expressa a deterioração do potencial de inovação do país e a consequente vulnerabilidade externa da política de saúde. O autor indica caminhos que compreendam a dinâmica de transformação econômica e institucional e não apenas os processos de alocação de recursos escassos, assim como a necessidade de compatibilização analítica e normativa entre a lógica econômica da inovação e a lógica sanitária, conforme demonstra a FIGURA 2.
A lógica empresarial capitalista penetra em todos os segmentos produtivos, envolvendo tanto as indústrias que já operavam tradicionalmente nessas bases quanto a segmentos que possuíam formas de organização em que era possível verificar a convivência de lógicas empresariais com outras que dela se afastavam, como a produção de vacinas e produtos biológicos, fitoderivados e a prestação de serviços de saúde [23].
O Estado é apontado como um ator essencial na promoção dessa articulação, uma vez que as políticas de saúde, além de sua dimensão social, também constituem mecanismos estratégicos para a consolidação de um sistema de inovação dinâmico, com efeitos diretos no desenvolvimento nacional, conforme demonstra a FIGURA 2.
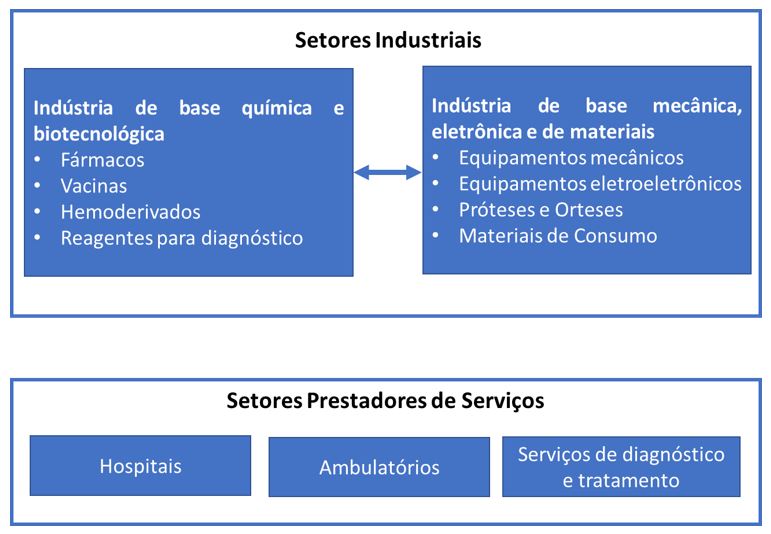
É digna de registro a elaboração de trabalhos que a partir de então, se valendo da perspectiva analítica do CIS, focalizaram o setor de fitomedicamentos, dentre os quais, destacam-se: "Desafio para inovação em fitomedicamentos no contexto da indústria farmacêutica"[24], no qual são discutidas a baixa competitividade do setor farmacêutico no País e a grande dependência de tecnologias externas, gerando um elevado déficit comercial na área e gastos elevados para o atendimento das necessidades de tratamento da população. Neste trabalho, a potencialidade dos fitomedicamentos é apontada como um nicho estratégico para o desenvolvimento tecnológico nacional e para uma maior autonomia do país nas políticas de medicamentos; "Aspectos críticos na formulação política de um sistema nacional de arranjos produtivos locais para o desenvolvimento de medicamentos de origem vegetal em cada bioma brasileiro"[25], registrando pela primeira vez uma interseção entre a dinâmica industrial em saúde, adotada no CIS, e a biodiversidade brasileira, sugerindo a necessidade de uma revisão dos conceitos teóricos relacionados a base de conhecimentos, para incorporar aqueles da biodiversidade. Os Arranjos e Sistemas Produtivos Locais a serem organizados em cada bioma brasileiro constituiriam esta nova base de conhecimentos, promovendo a inovação.
A ampliação do diálogo sobre a importância estratégica da Ciência Tecnologia e Inovação entre a Academia e tomadores de decisão, valendo-se ainda da coerência e transversalidade do novo enfoque do Complexo Industrial da Saúde, ganha espaço no espectro das políticas públicas brasileiras. É possível associar a realização da Conferência de Ciência, Tecnologia e Inovação em Saúde[18], assim como a reorganização da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, com a elaboração da Política Mais Saúde[26] e da Política Nacional de Ciência Tecnologia e Inovação em Saúde[27]. Além disto, a integração da saúde na política industrial e de inovação pode ser evidenciada no escopo das políticas Industrial e de Comércio Exterior[28], Ciência, Tecnologia e Inovação para o Desenvolvimento Nacional[29], Desenvolvimento Produtivo[30].
Em maio de 2008, mês em que foi anunciada a Política de Desenvolvimento Produtivo, o Banco Nacional de Desenvolvimento Econômico Social (BNDES) realizou, em parceria com o Ministério da Saúde e a Fiocruz, o Seminário sobre o Complexo Industrial da Saúde, com o objetivo de discutir a articulação entre inovação, acesso e desenvolvimento, e criar uma agenda positiva de intervenção para viabilizar as propostas contidas na política Mais Saúde. Na apresentação de abertura do evento, "Inovar e investir para sustentar o crescimento"[31] o presidente do BNDES elucidou que o CIS é um dos Programas Mobilizadores em Áreas Estratégicas da Política de Desenvolvimento Produtivo, sendo este programa elaborado em forte articulação com a também recente política Mais Saúde, do Ministério da Saúde. Em seguida são apresentados como os objetivos do programa do CIS[32] a consolidação de uma indústria uma indústria competitiva na produção de equipamentos médicos, materiais, reagentes e dispositivos para diagnóstico, hemoderivados, imunobiológicos, intermediários químicos e extratos vegetais para fins terapêuticos, princípios ativos e medicamentos para uso humano e o domínio do conhecimento científico-tecnológico em áreas estratégicas, visando à redução da vulnerabilidade do Sistema Nacional de Saúde. O programa tem como metas a redução do déficit comercial do CIS de U$ 5,5 bilhões em 2007 para US$ 4,4 bilhões até 2013 e desenvolver tecnologia para produção local de 20 produtos estratégicos para o SUS até 2013.
Entre os desafios, é destacado o adensamento da cadeia produtiva do CIS fortalecendo empresas nacionais assim como o fortalecimento, expansão e modernização da gestão da rede de laboratórios públicos. Como ações, são definidos:
- o uso do poder de compra estatal para estimular a produção local, tendo como medidas a revisão da regulamentação de compras governamentais, pré-qualificação, isonomia competitiva, desoneração tributária, encomenda de produtos estratégicos para a inovação em saúde e compras governamentais no valor de R$ 12 bilhões/ano entre 2008/2011;
- o financiamento para ampliação de capacidade de produção tendo como medidas o Novo Profarma: Programa de Apoio ao Desenvolvimento do Complexo Industrial da Saúde, para elevar a competitividade do complexo industrial da saúde, disseminando a atividade inovadora, aumentando a produção de equipamentos, materiais, medicamentos e produtos correlatos, contribuindo para inserção internacional das empresas nacionais, que contará com recursos do BNDES - R$ 3 bilhões entre 2008 e 2012, além dos Recursos Orçamentários do Ministério da Saúde- R$ 930 milhões entre 2008 e 2011;
- expansão de recursos para P&D em áreas estratégicas - R$ 1,1 bilhão do MS entre 2008 e 2013 e R$ 90,5 milhões do Fundo Setorial de Saúde (CT-Saúde) Orçamento 2008, além de recursos para Infraestrutura científico-tecnológica do MCT/ Finep- R$ 500 milhões entre 2008 e 2013.
Em 2012, um estudo destacou a importância de programas de apoio ao Complexo Econômico Industrial da Saúde (CEIS)[33] que contemplam tanto a expansão da capacidade produtiva no setor farmacêutico como a consolidação de competências para inovar, mencionando o Programa de Apoio ao Desenvolvimento da Cadeia Produtiva Farmacêutica do BNDES assim como os Projetos por meio dos Fundos Setoriais da Financiadora de Estudos e Projetos (FINEP) como o CT-Saúde e o CT-Bio, na superação de gargalos estruturais remanescentes no caminho da criação e implementação de políticas públicas que articulem o desenvolvimento da base produtiva e da inovação na indústria farmacêutica com o atendimento das demandas sociais relativas à saúde no País[34]. Os autores descreveram um panorama da indústria de base química e biotecnológica em saúde no Brasil, para argumentar que a ação reguladora do Estado torna-se crucial para viabilizar o aproveitamento de novas janelas de oportunidade que permitam articular o desenvolvimento da indústria de base química e biotecnológica em saúde com a política de saúde e com a demanda de bem-estar social, a despeito das dificuldades encontradas na implementação e de coordenação de instrumentos e ações para essa área. Destacam-se as linhas gerais de orientação das políticas de apoio ao desenvolvimento do complexo da saúde, cujas ações de coordenação e articulação vêm sendo desempenhadas pelo Grupo Executivo do Complexo Industrial da Saúde do Ministério da Saúde, descrevendo as seguintes medidas e instrumentos:
- a publicação da lista de produtos prioritários para o SUS (Portaria 1.284, de 2010), sinalizando quais deles constituem foco prioritário para o aumento da produção local, seja pela elevada importância social e econômica, pela sua relevância na busca de novas capacitações tecnológicas na área da saúde;
- a regulamentação da Lei 12.349 (Lei de Compras Públicas), que visa utilizar de forma escalonada uma margem de preferência de no máximo 25%, para licitação de produtos manufaturados e serviços nacionais resultantes de desenvolvimento e inovações tecnológicas realizadas no País;
- as Parcerias para Desenvolvimento Produtivo (PDP) envolvendo laboratórios oficiais e privados, visando prioritariamente internalizar a tecnologia de produção de fármacos e medicamentos estratégicos nos laboratórios públicos por meio de processos de transferência de tecnologia.
Em 2016, uma revisão discutiu as relações entre os sistemas de saúde de países desenvolvidos e em desenvolvimento com a indústria, focalizando o apoio do Estado à inovação farmacêutica[34]. O estudo considera crucial o estabelecimento de arranjos institucionais que aprimorem a ligação entre as áreas governamental, através das agências de financiamento, pesquisa em saúde, indústria e público para definir e conduzir uma agenda nacional que permita a consolidação do Sistema Único de Saúde brasileiro. A limitação de recursos públicos no sistema de saúde impede a exploração adequada das virtudes favorecidas pela interação com a indústria para atividades inovadoras e por outro lado, a simples manutenção das políticas em andamento até então não seria suficiente para garantir tais arranjos. Segundo o autor esta é a tarefa crucial a ser feita.
Pesquisa do Uso Medicinal da Cannabis sp.
O uso medicinal da Cannabis sp. é milenar, tendo sido descrito por Discórides ainda no Século I. No Brasil, sua ação farmacológica é descrita nos compêndios médicos e catálogos da década de 1930 como hipnótico, sedativo, calmante, usado em nevralgias, insônia, dispepsias etc. A despeito destes fatos, é de conhecimento público o impacto provocado pela II Conferência Internacional do Ópio, realizada em Genebra, em 1924, sobre o uso da Cannabis sp., dando início a sua proibição. No Brasil, a maconha foi criminalizada pelo artigo 281 do Código Penal de 1940[1,2]. As décadas que sucederam os anos de 1950 registraram dois grandes debates relacionados à Cannabis sp. no mundo: a sua descriminalização e seu uso medicinal. Hoje, em diversos países o uso da maconha já é liberado e controlado pelo Estado. Nas últimas décadas o uso medicinal voltou a ser foco de diversas pesquisas científicas, abrindo o caminho para o desenvolvimento tecnológico e inovação.
Entretanto, apesar de robustas evidências científicas sobre o uso medicinal da Cannabis sp., a produção de medicamentos a partir de suas substâncias farmacologicamente ativas ainda se encontra prejudicada pelo legado de sua criminalização ocorrida nos anos de 1940, ao contrário do que ocorreu com a morfina, intensamente utilizada até hoje nas práticas médicas, sendo a mesma derivada do ópio, criminalizado ainda nos anos de 1920.
Desde a sua proibição em escala global, a década de 1960 registrou estudos sobre os efeitos da Cannabis sp., inicialmente de caráter comparativo com outras substâncias proscritas como o ópio, heroína e cocaína, mas também com outras capazes de promover a dependência química como o álcool, abrindo assim duas vertentes de debates: a sua descriminalização e seu uso medicinal. De uma forma geral, tais estudos foram intensificados de forma crescente, nas décadas de 1990, 2000 e 2010. Entretanto, a despeito das evidências científicas sobre o seu uso medicinal e, também, sobre a sua característica de não causar dependência a Cannabis sp., ainda é considerada ilegal na maioria dos países. O principal argumento para a criminalização é o risco potencial à saúde associado ao constituinte psicoativo, o Δ-9 tetrahidrocanabinol mesmo sendo comprovado que em doses controladas, o mesmo seja benéfico à saúde. Por outro lado, verifica-se que o consumo de Cannabis para uso medicinal aumentou significativamente[35].
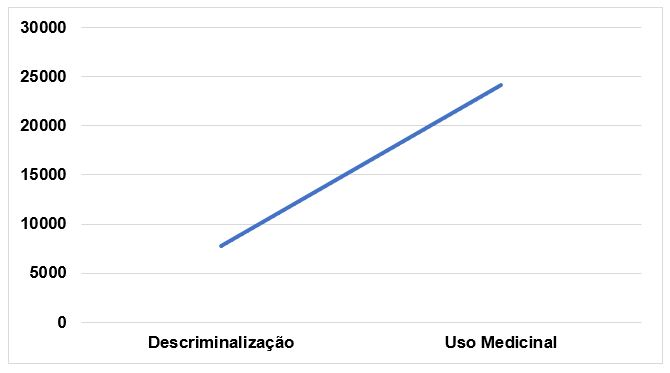
O debate sobre descriminalização da Cannabis sp. ganhou impulso nos últimos anos. O Uruguai, Canadá e vários estados dos EUA descriminalizaram e legalizaram o uso, permitindo assim o consumo, a regulamentação e o controle do Estado. Em diversos países a posse de pequenas quantidades de maconha foi autorizada. À medida que a descriminalização da Cannabis sp. passou a acontecer ao longo dos anos, a validação cientifica do uso medicinal da mesma aumentou consideravelmente[36]. Os debates sobre a descriminalização e o uso medicinal tiveram um crescimento exponencial sendo registrados em publicações no período de 1960-2019, mantendo uma correlação entre si. Os dados da FIGURA 3 demonstram uma correlação positiva entre os estudos encontrados sobre a descriminalização (n=7740) e o uso medicinal da Cannabis sp. (n=24100).
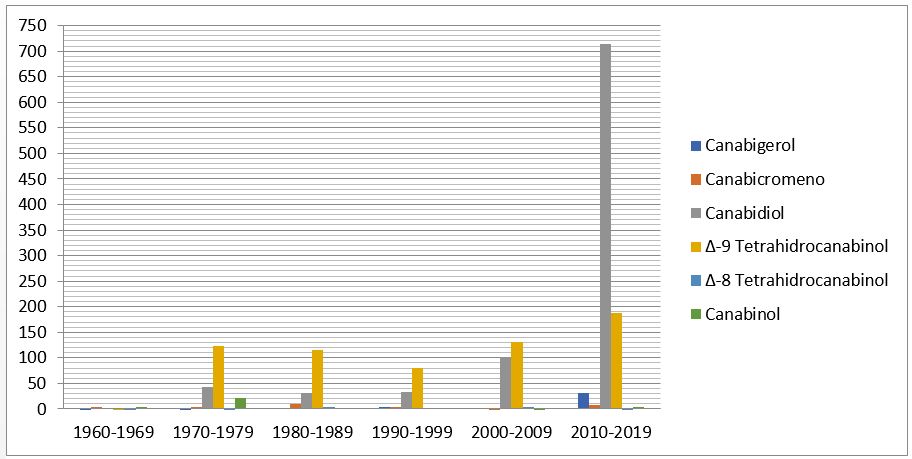
Por outro lado, a pesquisa científica estabeleceu, ao longo do período considerado neste estudo, bases sólidas para o uso medicinal da planta. A Cannabis é cultivada há mais de 6000 anos[35,36]. Existem duas espécies majoritárias deste gênero: a Cannabis indica e a Cannabis sativa, sendo diferenciadas por suas características físicas e os teores de seus constituintes químicos. Ao todo, a planta contém mais de 600 substâncias químicas (triterpenos, hidrocarbonetos, compostos nitrogenados, carboidratos, flavonoides, ácidos graxos, compostos fenólicos não canabinóides, álcoois, aldeídos, cetonas, ácidos, ésteres, lactonas). Entre os quais se destacam 66 canabinóides[37]. O número de trabalhos publicados, estabelecendo as atividades farmacológicas por categoria de fitocanabinóides durante o intervalo de 1960 até 2019 mostra um crescimento exponencial notadamente a partir dos anos 2000, conforme demonstra a FIGURA 4.

| Classe | Estrutura | Atividade Farmacológica |
| Canabigerol | R1 = COOH, R2 = C5H11, R3 = H | antibiótico, antifúngico, anti-inflamatório, analgésico |
| Canabicromeno | R1 = H, R2 = C5H11, R3 = CH3 | antibiótico, anti-inflamatório, antifúngico, analgésico |
| Canabidiol | R1 = H, R2 = C5 H11, R3 = H | anti-inflamatório, ansiolítico, antipsicótico, analgésico, antioxidante, antiespasmódico |
| Δ-9 Tetrahidrocanabinol | R1 = H, R2 = C5H11, R3 = H | anti-inflamatório, analgésico, euforizante, antioxidante, antiemético |
| Δ-8 Tetrahidrocanabinol | R1 = H, R2 = C5H11 | similar ao THC (menos potente) |
| Canabitriol | R1 = H, R2 = OH, R3 = C5H11 | Sedativo, Antibiótico, anticonvulsivante, anti-inflamatório |
| Canabiciclol | R1 = H, R2 = C3H7 | Sem registro de estudo farmacológico |
| Canabielsoína | R1 = COOH, R2 = C5H11, R3 = H | Sem registro de estudo farmacológico |
| Canabinol | R1 = H, R2 = H, R3 = C5H11 | Sem registro de estudo farmacológico |
| Canabinóides Mistos | Fórmulas Variadas | Sem registro de estudo farmacológico |
| Fonte: elaboração própria, 2019. | ||
Destacam-se as classes Canabidiol (CBD) e Δ-9 tetrahidrocanabinol (TCH) na curva de crescimento dos estudos farmacológicos publicados, sendo suas atividades descritas como: ansiolítico, antipsicótico, analgésico, anti-inflamatório, antioxidante e antiespasmódico[37,38].
O CBD e o THC são os canabinóides mais pesquisados, apresentando entre si, perfis e mecanismos de ação diferentes. O THC interage com vários alvos farmacológicos[39], atuando primeiramente sobre os receptores neuronais pré-sinápticos CB1 para inibir a liberação contínua de neurotransmissores. A administração repetida de THC pode oferecer tolerância a efeitos e ação de endocanabinoide[39,40]. O CBD diferentemente do THC não tem uma janela terapêutica tão estreita[40,41]. Além dos receptores CB1, o CBD age sobre os receptores CB2, com baixa afinidade para ambos[42,43]. Alguns pesquisadores têm sugerido que o CBD pode influenciar os efeitos do THC, aumentando a eficácia clínica e reduzindo os efeitos adversos[44]. Para elucidar os efeitos farmacológicos do CBD e THC, bem como a sinergia entre ambos, foram selecionados 16 estudos apresentados abaixo no QUADRO 2.
| Autor/Ano | Objetivo | Doses | Considerações |
| Karniol et al. (1974) | Investigar se o composto THC + CBD induz menos efeitos psicotrópicos quando comparados ao THC sozinho. | Grupo 1: THC oral 30 + CBD oral 15, 30 ou 60 mg; Grupo 2: THC oral 30 mg; Grupo 3: placebo oral | O CBD pareceu bloquear o efeitos provocadores de ansiedade do THC; Verificou-se que o CBD atenua vários efeitos do THC, como aceleração da taxa de pulso, tempo comprometimento da produção e distúrbios psicológicos. |
| Hollister e Gillespe (1975) | Investigar se o CBD e o CDN interagem diretamente nos efeitos do THC. | Grupo 1: THC oral 20mg + CBD 40mg; Grupo 2: THC oral 20mg; Grupo 3: Placebo. | O início dos efeitos do THC + CBD comparado ao THC sozinho foi um pouco mais lento; As alterações da taxa de pulso foram semelhantes entre tratamentos = Metabolitos em amostras de urina foram mais numerosos seguintes a combinação THC + CBD do que depois do THC sozinho. |
| Dalton et al. (1976) | Avaliar a interação entre o THC e o CBD em doses típicas de usuários de fumo da Cannabis. | Grupo 1: Via vaporizada THC 0,025mg + CBD 0.150mg / kg; Grupo 2: via vaporizada (fumo) THC 0,025 mg; Grupo 3: Placebo | CBD + THC combinados reduziu o sentimento subjetivo estimulante quando comparado ao THC sozinho; Não foram afetados a frequência cardíaca e o desempenho de tarefa de feedback auditivo. |
| Dalton et al. (1976) | Avaliar a interação entre o THC e o CBD em doses típicas de usuários de fumo da Cannabis. | Grupo 1: Pré-tratamento (T-30mins) oral /vaporizado (fumo) com CBD 0,150mg / kg, seguido por THC 0,025 mg / kg; Grupo 2: THC vaporizado 0,025 mg / kg; e Grupo 3: Placebo | O pré-tratamento com CBD não alterou os efeitos do THC. |
| Bird et al. (1980) | Avaliar de todas as formas possíveis as combinações do CBD e o THC para alcoolismo. | THC oral 0,215 mg /kg + CBD 0.320 mg / kg oral; THC 0,215 mg oral; placebo oral | Quando co-administrado CBD não modificou os efeitos de THC; quando somente administrado o THC, foi constatado que o desempenho cognitivo, perceptivo e motor foi alterado; hiperemia conjuntival e intoxicação subjetiva também foram percebidas. |
| Hunt et al. (1981) | Investigar os efeitos farmacocinéticos do CBD combinado com o THC. | Grupo 1: Pré-tratamento (T-480, -300, -120 mins) por via oral com CBD 500 mg, seguido de THC 2mg intravenoso; Grupo 2: pré-tratamento (T480, -300, -120 minutos) oral Placebo, seguido por THC 2mg intravenoso | O pré-tratamento com CBD não alterou a farmacocinética ou os efeitos farmacodinâmicos do THC (Grupo 1); Deve haver um efeito mínimo sobre a formação e excreção de metabólitos. |
| Zuardi et al. (1982) | Investigar se o CBD diminuiu a ansiedade produzida por THC em voluntários saudáveis. | a) Grupo 1: Via oral - THC 0.5 mg/kg + CBD 1mg/kg; b) Grupo 2: Via oral - THC 0.5 mg/kg; Grupo 3: Placebo | O Grupo 2 teve a taxa de pulsação aumentada quando tratado com THC, o que não correu com o Grupo 1, que teve combinado o CBD, bloqueando a ansiedade provocada pelo THC. |
| Guy e Robson. (2003) | Para avaliar o perfil farmacocinético, segurança e tolerabilidade de CBD e THC. | a) Spray THC 10mg + CBD 10 mg; b) spray THC 10mg; c) spray Placebo | Tratamentos revelaram scores de intoxicação baixos e os efeitos não relacionados. A concentração plasmática de THC foi estatisticamente significativamente tardia quando administrado junto com o CBD. É possível que a presença do CBD na formulação CBD + THC atrase a absorção de THC. |
| Nicholson et al. (2004) | Avaliar os efeitos de extratos de cannabis no desempenho dos períodos de sono noturno e manhã e a afetabilidade na memória e sonolência. | a) Spray THC 15mg + CBD 15mg; b) spray THC 15mg; c) spray Placebo | Ambos tratamentos com THC sozinho e em combinação com CBD aumentaram a sonolência; O THC + CBD alterou o humor negativamente; Em contrapartida, a administração de THC sozinho provocou a diminuição do estágio 3 do sono e aumento do tempo gasto acordado; THC diminuiu as latências para sono de manhã cedo e memória episódica comprometida, não presente com THC + CBD; |
| Juckel et al. (2007) Nadulski et al. (2005); Roser et al. (2009) Roser et al. (2008) Stadelmann et al. (2011) |
Investigar os efeitos do CBD sobre a farmacocinética do THC. Análise secundária: investigar estados psicóticos e esquizofrênicos; amplitude psicomotora; | a) oral: THC 10mg + CBD 5.4mg; b) oral: THC10 mg; c) oral: Placebo | Desfechos primários: CBD inibe o metabolismo hidroxilação de THC; mas o efeito é pequeno; > 10 /> 10 genótipos mostraram uma diminuição da amplitude do P300 e prolongamento da latência do P300 sob THC sozinho, mas não THC + CBD; |
| Bhattachary ya et al. (2010) | Investigar se o tratamento com CBD pode impedir THC de provocar sintomas psicóticos. | a) Tratamento (T-5mins) intravenoso com CBD 5 mg, seguido por THC 1,25mg ; b) tratamento (T-5mins) por via intravenosa, Placebo. | Nenhuma diferença significativa nos níveis sanguíneos com a administração do THC com ou sem pré-tratamento com CBD; Foi evidenciado que o THC aumentou os sintomas psicóticos em alguns voluntários. |
| Englund et al. (2013) | Investigar se o tratamento com CBD atenuaria os sintomas psicóticos positivos e o comprometimento cognitivo causado pelo THC. | a) tratamento (T-210 minutos) com CBD oral 600mg seguido por THC 1,5mg intravenoso; b) tratamento (T-210 minutos) placebo oral, seguido por THC 1,5mg intravenoso. | Aumento clinicamente significativo em sintomas positivos após THC eram mais comuns no grupo tratado com placebo comparado com o grupo tratado com CBD; A paranoia pós-THC foi menor no grupo CBD; O CBD inibiu os efeitos de THC na memória episódica; Nenhuma diferença na concentração plasmática entre grupos |
| Hindocha et al. (2015) Morgan et al. (2018) Wall et al. (2019) |
Determinar os efeitos do THC e CBD, sozinho e em combinação em reconhecimento facial, emocional e de memória. | a) THC 8 mg + CBD 16mg vaporizado; b) THC 8 mg vaporizado; c) Placebo vaporizado. | Desfechos primários: CBD reduziu o prejuízo de reconhecimento de 40% dos indivíduos que fizeram uso do THC concomitante; A influência do CBD no THC pode diferir de acordo com variação no endocanabinoide genética do sistema. |
| Haney et al. (2016) | Avaliar a influência do CBD oral no reforço no reforço, subjetivo, cognitivo e fisiológico quando concomitantemente uso o THC. | a) Tratamento (T-90mins) oral CBD 200, 400, 800 mg seguido por THC 42mg vaporizado; b) tratamento (T90mins) ora Placebo seguido por THC 42mg vaporizado. | CBD não alterou significativamente o aumento subjetivo efeitos de intoxicação; CBD não apresentou influência significativa da frequência cardíaca máxima. |
| T. P. Freeman, Pope, et al. (2018) Lawn et al. (2016) Wall et al. (2019) |
Examinar os efeitos do composto THC + CBD e THC sozinho. | a) THC 8mg + CBD 10mg vaporizado; b) THC 8 mg vaporizado; c) placebo vaporizado. | Desfechos primários: o CBD não afeta motivação; aparenta ter uma redução da agitação do THC quando adicionado o CBD. Resultados secundários: Maior percepção sonora aprimorada após THC + CBD que THC; O THC sozinho diminuiu a resposta à música em vários núcleos de recompensa e emoção do cérebro, ao passo que THC + CBD não diferem do placebo e mostraram maior conectividade; THC sozinho reduziu a conectividade dentro quando comparado com THC + CBD. |
| Arkell et al. (2019) | Comparar os efeitos subjetivos, cognitivos, e relacionados a vaporização do THC sozinho e THC e CBD combinados. | a) THC 3,75 mg + CBD 13,75 mg vaporizado; b) THC 13,75mg + CBD <1,25mg vaporizado; c) Placebo vaporizado com <1,25 mg de THC / CBD | Concentrações plasmáticas máximas de THC maior em THC + CBD; Nenhuma diferença na autoclassificação de intoxicação subjetiva ou confiança para dirigir por THC e THC + CBD = STAI e autoavaliação ansiosa aumentou tanto em THC quanto em THC + CBD aos 15 minutos, mas não THC + CBD em 1 hora. |
| Fonte: elaboração própria, 2019. | |||
Os resultados acima demonstram a aplicabilidade da planta "Cannabis sp." no tratamento de diversas doenças. As concentrações de THC e CBD podem variar entre função do uso medicinal dos mesmos[36,37]. Outro aspecto importante destacado nesta pesquisa é que o tratamento com produtos à base de CBD reduz significativamente a frequência de crises epilépticas, mesmo em pacientes refratários[39-43]. Outros estudos comprovam que um extrato de CBD enriquecido com outros canabinóides, como o THC, amplia sua eficácia quando comparado a administração do extrato de CBD puro [44-45]. Este efeito sinérgico é claramente descrito, por exemplo, na ação farmacológica contra a dor[45], assim como em outras ações farmacológicas, tais como a catatonia e arreflexia da córnea[46,47]. Todos os resultados sugerem que esses efeitos se devem à modulação alostérica dos receptores CB1 canabinóides pelo CBD. Isso significa que o CBD exerce um "ajuste fino" do receptor CB1 canabinóide afetando a interação de outros canabinóides ao nível do receptor[46,47].
De um modo geral, é possível afirmar que a pesquisa científica contribuiu progressivamente de forma sólida, ao longo das décadas recentes, para a validação do uso medicinal da Cannabis sp., estabelecendo assim o ponto de partida para o desenvolvimento tecnológico e inovação de produtos farmacêuticos a base de canabinóides.
Judicialização e Regulação no acesso a medicamentos
No Brasil, a discussão sobre o acesso a fitomedicamentos contendo canabinóides tem sido pautada tanto no campo do Direito, revelando sua inscrição tanto no processo de judicialização da medicina, quanto no campo da Regulação, deixando de considerar, entretanto, o impacto da Inovação em Saúde na questão do acesso.
O processo de judicialização da saúde é um fenômeno contemporâneo observado especialmente nos países em que o Poder Judiciário realiza o controle de constitucionalidade das leis. Neste contexto, se inserem decisões judiciais nas ações para fornecimento de medicamentos, revelando uma forma de interferência do Poder Judiciário na política de saúde, sobrepondo-se desta forma ao Poder Executivo na escolha de fornecimento deste ou daquele medicamento, sob o fundamento de assegurar o direito à saúde. Este formato de judicialização contempla a busca individual de cidadãos por meio de procedimentos judiciais comuns à efetivação de interesses relacionados ao direito social à saúde, não efetivados na esfera executiva[48].
A Constituição de 1988, no artigo 196 estabelece que:
[...] a saúde é direito de todos e dever do Estado, garantindo mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal e igualitário às ações e serviços para sua promoção, proteção e recuperação[49].
O Sistema Único de Saúde (SUS) brasileiro foi concebido pela Constituição Federal e regulamentado pela Lei n° 8080 de 1990, observando que o dever do Estado é garantir a saúde e consiste na formulação e execução de políticas econômicas e sociais que visem à redução de riscos de doenças e de outros agravos e no estabelecimento de condições que assegurem acesso universal e igualitário às ações e aos serviços para a sua promoção, proteção e recuperação.
Destaca-se ainda, no campo de atuação do SUS, a formulação da política de medicamentos, equipamentos, imunobiológicos e outros insumos de interesse para a saúde e a participação na sua produção[50]. Em 1988 o Brasil aprova a Política Nacional de Medicamentos (PNM)[51] com o propósito principal de "garantir a necessária segurança, eficácia e qualidade dos medicamentos, a promoção do uso racional e o acesso da população a aqueles considerados essenciais". Em tempo, é importante esclarecer que o conceito de medicamentos essenciais que os define como sendo aqueles que satisfazem às necessidades de saúde da maioria da população, a um preço que a comunidade possa pagar, foi elaborado no âmbito da Organização Mundial da Saúde (OMS) ainda na década de 1970, tendo resultado na publicação de sua primeira lista de medicamentos essenciais em 1977[52]. A aprovação da Relação Nacional de Medicamentos Essenciais (RENAME), no ano de 2000, foi considerada fundamental para ações de planejamento, seleção de medicamentos e de organização da assistência farmacêutica no âmbito do SUS, uma vez que o cenário da década de 1990 descrevia o aumento da demanda de medicamentos, uma desarticulação da assistência farmacêutica, abastecimento irregular e a consequente falta de acesso aos medicamentos.
Finalmente, esta RENAME foi resultado de ampla consulta nacional que estabeleceu uma lista de medicamentos efetivamente adequada às necessidades brasileiras e inserida no âmbito das políticas sociais do Governo Federal[53].
Nesta trajetória é possível observar que processo judicial, voltado para o acesso aos insumos, medicamentos, cirurgias e equipamentos iniciado na década de 1990, foi marcado inicialmente por solicitações de medicamentos para o tratamento da Síndrome de Imunodeficiência Adquirida (AIDS)[54], contando a partir de então com um aumento progressivo de solicitações.
Em 2004, a Política de Assistência Farmacêutica foi aprovada pelo Conselho Nacional de Saúde como parte integrante da Política Nacional de Saúde[55] garantindo de um lado, os princípios da universalidade, integralidade e equidade, através de um conjunto de ações voltadas à promoção, proteção e recuperação da saúde e de outro, a formulação de diferentes políticas, como aquelas de medicamentos, ciência e tecnologia, desenvolvimento industrial, no âmbito do SUS, ampliando o debate sobre o direito ao acesso e o compromisso do Estado no fornecimento de medicamentos.
A judicialização, envolvendo medicamentos contendo canabinóides, ganha um novo patamar e expressão a partir de um marco regulatório, a Resolução da Diretoria Colegiada (RDC) n° 17 da Agência Nacional de Vigilância Sanitária de 2015[55]. Esta Resolução definiu os critérios e os procedimentos para a importação, em caráter de excepcionalidade, de produto à base de Canabidiol em associação com outros canabinóides, por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde. O Art. 18 dessa RDC definiu que a solicitação de autorização para importação de produtos à base de Canabidiol, em associação com outros canabinóides, dentre eles o THC, que não constem na Lista do Anexo I, mas que possam vir a cumprir com os critérios desta Resolução, estará sujeita a avaliação da ANVISA. Ressalta-se que na ocasião da publicação da RDC 17/15, a Lista do Anexo I era composta apenas por três empresas norte-americanas, a saber: Cibidex. InC; Bluebird Botanicals e Revivid, não sendo as mesmas companhias farmacêuticas.
A partir de então, houve um aumento considerável das solicitações individuais para importação via ANVISA, mas também de ações judiciais para assegurar o acesso ao tratamento de diversas patologias relacionadas[56]. As empresas começaram a solicitar à ANVISA autorização para o cultivo da planta para produção de medicamentos e realização de pesquisas científicas[57]. A ANVISA elaborou a Nota Técnica nº 093/2015 com orientações para a aquisição intermediada de produtos à base de canabidiol por Secretarias de Saúde para atendimento de decisões judiciais[58]. Em 2016, a Cannabis medicinal foi incluída na lista de plantas e substâncias de controle especial, Portaria nº 344, de 1998, do Ministério da Saúde, possibilitando o registro de medicamento à base dos derivados da planta[59]. No mesmo ano, foi divulgada a atualização da lista de produtos com canabidiol com autorização simplificada para a importação. A Resolução da Diretoria Colegiada (RDC) 128/2016 acrescentou ao Anexo I da RDC 17/15 mais produtos à base de Canabidiol em associação com outros canabinóides[60].
Em 2017, as atividades regulatórias se intensificaram ainda mais. A Agenda Regulatória da ANVISA para 2017-2020 incluiu o tema sobre o Cannabidiol[61]. Foi divulgada a aprovação do Mevatyl®, primeiro registro no Brasil de medicamento industrializado feito à base de Cannabis medicinal[62]. O Grupo de Trabalho (GT) para a discussão dos requisitos de segurança e controle para o cultivo da Cannabis medicinal concluiu suas atividades indicando a necessidade de abertura de processo regulatório sobre o assunto[63]. Foi publicada a Resolução da Diretoria Colegiada (RDC) 156/2017, que incluiu a Cannabis na lista das Denominações Comuns Brasileiras (DCBs)[64] abrindo o caminho para seu registro como medicamento.
Finalizado o Relatório Preliminar de Análise de Impacto Regulatório (AIR) sobre o tema, em 2019, a Diretoria Colegiada (DICOL) aprovou propostas de consultas públicas relacionadas à regulamentação da Cannabis medicinal (cultivo da planta para fins medicinais e científicos e registro e monitoramento de medicamentos). Foram publicadas no Diário Oficial da União (D.O.U.) as Consultas Públicas 654 (requisitos para registro e monitoramento)[65] e 655 (requisitos para cultivo)[66]. Após o envio de consultas dirigidas a 29 entidades, solicitando contribuições sobre as propostas normativas, a DICOL aprovou a realização de Audiência Pública para coletar subsídios sobre as propostas em consulta. A Agência passa a discutir a regulamentação da Cannabis medicinal no Brasil em Audiências Públicas na Câmara dos Deputados e no Senado, assim como em Audiência Pública interna, reunindo seus diretores e 240 participantes para debater o assunto. Em seguida, foi realizada a análise das contribuições recebidas (1154) durante as Consultas Públicas, Audiência Pública e Consultas Dirigidas, sendo então consolidadas as propostas de regulamentação. Em 11 de Dezembro de 2019 foi publicada, no D.O.U., a RDC nº 327, da ANVISA, que dispõe sobre os procedimentos para a concessão da Autorização Sanitária para a fabricação e a importação, bem como estabelece requisitos para a comercialização, prescrição, a dispensação, o monitoramento e a fiscalização de produtos de Cannabis para fins medicinais, e dá outras providências[67].
Um estudo recente que aborda a questão do custo da judicialização da saúde relacionado à solicitação de medicamentos fornecidos pelo SUS, revela a insuficiência na oferta somada a ineficiência da gestão de recursos públicos como origem desses processos, mas aponta que os mesmos foram responsáveis por um aumento de 5689% nos gastos do Ministério da Saúde entre os anos de 2015 e 2017. A previsão de 7 bilhões de desembolso de estados, municípios e União, correspondendo a cerca de 5% do orçamento total da saúde, aponta que as decisões judiciais visando o direito à vida e à saúde não observam as regras orçamentárias, podendo comprometer ou inviabilizar a realização das políticas de saúde[68].
Finalmente, a recente publicação da RDC nº 327, da Anvisa, em 2019, representa um marco histórico no caminho para a fabricação e importação de produtos da Cannabis no Brasil, não resolvendo, entretanto, o paradoxo do acesso aos medicamentos à base de canabinóides uma vez que não foram resolvidas as ações judiciais que envolve o cultivo da planta entre outras, impedindo assim o caminho da inovação em saúde para garantir o amplo acesso.
Discussão do acesso sob novo prisma
Como visto anteriormente, o caminho da judicialização como um meio de garantir o acesso pode comprometer o orçamento da saúde, dada a vigência do teto de gasto no governo federal, instituído por meio da Emenda Constitucional n° 95/2016[69]. Inovação e acesso são conceitos que pertencem a diferentes áreas de conhecimento, identificadas na dinâmica do setor saúde. No campo farmacêutico, as várias dimensões do conceito de acesso refletem um diferencial de direito e de cidadania, legítima aspiração de bem-estar. Em 2009, a relação entre inovação e acesso foi esclarecida em uma pesquisa, a partir da análise das políticas públicas relacionadas ao desenvolvimento do complexo industrial da saúde[70]. A pesquisa descreve os conceitos de inovação e acesso considerando o enfoque analítico do complexo produtivo e industrial da saúde, sendo os mesmos articulados tanto no lado da oferta, quanto da demanda. A oferta, ligada à inovação, define a competitividade e o desempenho industrial da indústria farmacêutica no mercado de produtos para a saúde. As estratégias de competitividade levam em consideração o investimento e esforço em P&D, assim como a propaganda farmacêutica. Pelo lado da demanda, o acesso está ligado à necessidade de uma determinada solução tecnológica, sendo suas características definidas pelo perfil epidemiológico da população. No caso de produtos farmacêuticos, as soluções tecnológicas permitiriam, em última análise, o acesso efetivo. Casas[70] destaca ainda três pontos relacionados ao acesso:
- a disponibilidade (availability) dos produtos se defronta com a superação de uma defasagem promovida pela distribuição desproporcional de recursos investidos em P&D, considerando países desenvolvidos e em desenvolvimento, para o estudo de doenças que os afetam;
- a capacidade de aquisição dos produtos farmacêuticos pela população (affordability), estando relacionada à proteção do conhecimento, da propriedade intelectual que gera o monopólio de mercado e por consequência, a imposição do preço;
- a propaganda, que induz ao consumo de produtos, contrapondo à doutrina do uso racional de medicamentos e a reivindicação do profissional médico como profissional liberal e sua liberdade de prescrição. Pondera, por fim, que o enfoque do Complexo Industrial da Saúde reconhecendo esta contradição inerente às duas lógicas propõe resolvê-las no âmbito do Estado através da elaboração de políticas que coloquem a saúde como fator endógeno de desenvolvimento e o fortalecimento da base produtiva nacional como elemento estratégico. Uma inovação necessária para o país orientada ao acesso.
Em uma análise recente da experiência brasileira um aumento das capacidades inovadoras no setor farmacêutico brasileiro é evidenciado. Brito e Vargas[71] apresentam uma revisão dos principais argumentos teóricos para justificar uma abordagem "sistêmica" e "inclusiva" das atividades inovadoras no processo de desenvolvimento econômico. Destacam ainda, as recentes mudanças institucionais na estrutura geral da política brasileira de inovação assumindo as bases conceituais do "Complexo Industrial da Saúde" (CIS). O Brasil tem um acúmulo de capacidades com níveis de excelência nas principais áreas científicas da Saúde, podendo se transformar em capacidades inovadoras, ligadas ao setor industrial para o desenvolvimento de novos produtos e processos, entre os quais novos medicamentos. Ressaltam-se, entretanto, a necessidade de superação da incompatibilidade existente entre o grau de capacidade científica e a capacidade limitada de inovação no setor industrial, sendo esta uma questão crítica para a participação do Brasil em novas plataformas tecnológicas estratégicas de inovação em saúde, exigindo para tanto o aumento da dinâmica das ligações entre o Sistema Nacional de Inovação em Saúde e o Complexo Econômico Industrial da Saúde (CEIS). Em seus argumentos, Brito e Vargas[71] ressaltam os seguintes aspectos:
- A economia global da aprendizagem não oferece caminhos simples e universais para guiar a política de inovação, enfatizando a relevância de um processo de aprendizagem desenvolvido por meio de experimentação e experiência em cada país;
- A formulação de políticas baseia-se no conhecimento, na experiência e no envolvimento dos principais interessados nos processos de diálogo e tomada de decisão, os quais podem gerar soluções viáveis e bem adaptadas a contextos institucionais específicos. No contexto dos países em desenvolvimento, devem ser considerados os impactos de atividades inovadoras para reduzir a heterogeneidade produtiva, os desequilíbrios regionais e as desigualdades sociais;
- Na última década, o Brasil implementou um conjunto de políticas destinadas a incentivar a inovação, a fim de reduzir a lacuna tecnológica enfrentada pela indústria local e mitigar as desigualdades sociais e regionais associadas aos processos de inovação;
- O impacto de inovações incrementais que conduzem ao aumento de produtividade é de grande relevância, representando uma conjugação de uma ideia inovadora e um mercado potencial;
- No campo da inovação/incorporação tecnológica, destaca-se a área da saúde, uma vez que a assistência à saúde vem incorporando continuadamente tecnologias desenvolvidas predominantemente por empresas transnacionais. O setor saúde apresenta especificidades importantes com elevado dinamismo em termos de taxa de crescimento e de competitividade e é constituído por setores econômicos onde a indústria farmacêutica é líder em termos de produção em saúde;
- O estabelecimento de um programa de Parcerias para o Desenvolvimento Produtivo (PPDs) proporciona meios para a transferência de tecnologia entre laboratórios públicos e privados, tornando-se um dos pilares da articulação entre a Política de Saúde e a Política de Inovação, representando entre 2011 e 2014 uma receita de US $ 4,5 bilhões para os laboratórios públicos, ao mesmo tempo em que entre 2010 e 2015, esses acordos representaram uma economia de aproximadamente US $ 900 milhões para o governo devido ao processo de negociação de preços.
Resumindo, a questão do acesso a medicamentos, sejam biomedicamentos, essenciais, genéricos ou fitomedicamentos, está ligada a insuficiência ou inexistência da oferta dos mesmos. A insuficiência por sua vez, pode ser uma consequência do alto custo ou mesmo da ineficiência na gestão pública em garantir a oferta. Uma defasagem tecnológica é responsabilizada pela permanência da grande dependência externa de fármacos e insumos terapêuticos, impactando na oferta de novos medicamentos no Brasil. A perspectiva dinâmica e socialmente inclusiva da inovação em saúde registra a criação de dispositivos para lidar com a transferência tecnológica de forma a promover a inovação em medicamentos e sua produção em larga escala, ampliando o seu acesso. Desta forma, as PDPs podem ser vistas como uma alternativa para a produção nacional de medicamentos da Cannabis.
A Lei n° 13.243, de 11 de janeiro de 2016, que dispõe sobre incentivos à inovação e à pesquisa científica e tecnológica no ambiente produtivo no Brasil[72], modificando a Lei Nacional de Inovação n° 10.973, de 2 de dezembro de 2004[73], representou um grande marco político da inovação. Nela, são definidas as possibilidades para o estabelecimento de Parcerias para o Desenvolvimento Produtivo em diversas modalidades entre Instituições de Ciência e Tecnologia, Empresas privadas e Empresas Públicas. As PDPs foram, ao mesmo tempo, consideradas estratégicas para o Sistema Único de Saúde de acordo com a Portaria n° 2.531, de 12 de novembro de 2014[74], que redefiniu as diretrizes e os critérios para a lista de produtos estratégicos para o Sistema Único de Saúde (SUS), assim como para o estabelecimento das PDPs, disciplinando os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS e o respectivo monitoramento e avaliação. Esta iniciativa instituiu prazos e fases relacionadas ao seu desenvolvimento, estabelecendo em 10 anos o prazo máximo para a execução das fases da parceria, incluindo a finalização da transferência tecnológica.
A discussão sobre o acesso aos medicamentos derivados da Cannabis sp., à luz da inovação em saúde, elucida como o acesso aos medicamentos, sejam eles biomedicamentos, essenciais, genéricos ou medicamentos desenvolvidos a partir da Cannabis sp. encontra-se ligado à insuficiência ou inexistência da oferta dos mesmos. A ausência da oferta possivelmente está relacionada tanto ao custo do desenvolvimento quanto a uma defasagem tecnológica e elevada dependência externa de fármacos e insumos terapêuticos. Sinaliza, ainda, que na perspectiva dinâmica e socialmente inclusiva da inovação em saúde, baseada no enfoque analítico do Complexo Econômico Industrial da Saúde, as PDPs podem ser vistas como uma alternativa para a produção nacional de fitomedicamentos da Cannabis, ampliando desta forma o acesso.
Conclusão
A pesquisa do uso medicinal da Cannabis sp., no período entre os anos de 1960 e 1990, demonstrou que a Ciência contribuiu de forma sólida e crescente para a validação do uso medicinal da Cannabis sp., abrindo o caminho para o desenvolvimento tecnológico e inovação de produtos farmacêuticos a base de canabinóides. Entretanto, apesar das robustas evidências científicas do uso medicinal da Cannabis sp., a produção de medicamentos a partir de suas substâncias farmacologicamente ativas ainda se encontra prejudicada pelo legado de sua criminalização ocorrida nos anos de 1940, ao contrário do que ocorreu com a morfina, intensamente utilizada até hoje nas práticas médicas, sendo a mesma derivada do ópio, criminalizado ainda nos anos de 1920.
As decisões judiciais, visando o direito à vida e à saúde, não observam as regras orçamentárias, podendo comprometer ou inviabilizar a realização das políticas de saúde como um todo no país, apresentando desta forma o desafio de se pensar o acesso aos produtos da Cannabis em outras bases que não sejam via Judicialização.
A discussão sobre o acesso aos medicamentos derivados da Cannabis sp., à luz da inovação em saúde, elucida como o acesso aos medicamentos, sejam eles: biomedicamentos, essenciais, genéricos ou medicamentos desenvolvidos a partir da Cannabis sp. encontra-se ligado à insuficiência ou inexistência da oferta, ou seja, encontra-se ligado à inovação em saúde. As PDPs podem ser vistas como uma alternativa para a produção nacional de fitomedicamentos da Cannabis, ampliando desta forma o acesso.
Para assegurar o êxito das PDPs, medidas regulatórias mais abrangentes são requeridas, considerando a cadeia de desenvolvimento tecnológico e produção, a partir do cultivo da planta, assim como o necessário reconhecimento dos medicamentos, contendo os canabinóides como estratégicos, pelo Sistema Único de Saúde.
Referências
1. Carline EA. A histórica da maconha no Brasil. J Bras Psiq. 2006; 55(4):314-317, Disponível em: [CrossRef] [Link]. Acesso em: 03 jan. 2020.
2. Barros A, Peres M. Proibição da maconha no Brasil e suas raízes históricas escravocratas. Rev Perif. 2011; 3(2):1-20. Disponível em: [Link]. Acesso em: 03 jan. 2020.
3. Gil AC. Métodos e técnicas de pesquisa social / Antônio Carlos Gil. 6ª ed – São Paulo: Atlas, 2008. ISBN: 978-85-224-5142-5. Disponível em: [ Link]. Acesso em: 03 jan. 2020.
4. Godin B. The making of science, technology and innovation policy: conceptual frameworks as narratives, 1945-2005. Centre Urbanisation Culture Société: 2009. 412p. Disponível em: [Link]. Acesso em: 03 jan. 2020.
5. Lundvall BA, Borrás S. The globalizing learning economy: implications for innovation policy – Report based on contributions from seven projects under the TSER programme, DG XII, Commission of the European Union. 1997. Disponível em: [Link]. Acesso em: 04 jan. 2020.
6. Lastres H, Albagli S. Informação e globalização na era do conhecimento. Editora: Campus Ltda: 1999. 163p. ISSBN: 853520489X
7. Corazza RI, Fracalanza PS. Caminhos do pensamento neo-schumpeteriano: para além das analogias biológicas. Nova Econ Belo Horiz. 2004; 14(2):127-155. Disponível em: [Link]. Acesso em: 05 jan. 2020.
8. Possas ML. Economia evolucionária neo-schumpeteriana: elementos para uma integração micro-macrodinâmica. Est Avan. 2008; 22(63):281-305. ISSN 0103-4014. Disponível em: [CrossRef] [Link]. Acesso em: 05 jan. 2020.
9. Gibbons M. The New Production of Knowledge: Dynamics of Science and Research in Contemporary Societies. British Library Cataloguing in Publication data, 1ª ed., 1994. ISBN: 9-787-446-265-871. Disponível em: [ Link]. Acesso em: 05 jan. 2020.
10. Nelson RR, Winter SG. In search of useful theory of innovation. Res Pol. 1977; 6(1): 36-76. Disponível em: [CrossRef] [Link]. Acesso em: 05 jan. 2020.
11. Schumpeter JA. The theory of economic development. Harvard University Press, Cambridge, Mass, 5ª ed., 255p. 1955. ISBN: 9780674879904.
12. Schumpeter JA. Capitalismo, socialismo e democracia. Editora: Fundo de Cultura: 1961. 488p. ISBN: 0061330086.
13. Nelson RRW, Sidney G. An evolutionary theory of economic change. Cambrigde: 1982. ISBN: 0-674-27228-5.
14. Dosi G. Technological paradigms and technological trajectories. Res Pol. 1982; 11(1):147-162. Disponível em: [CrossRef] [Link]. Acesso em: 06 jan. 2020.
15. Lundvall B-Å. National systems of innovation towards a theory of innovation and interactive learning. Towards a theory of innovation and interactive learning. Pinter Publishers. 1992. ISBN: 978-1855673380.
16. Freeman MC. The National System of Innovation in historical perspective. Camb J Econ. 1995; 19:5-24. Disponível em: [Link]. Acesso em: 06 jan. 2020.
17. Lundvall B-Å. Why the New Economy is a Learning Economy. Copenhagen Business School, Department of Industrial Economics and Strategy/Aalborg University, Department of Business Studies. 2004; p. 1-13. Disponível em: [Link]. Acesso em: 07 jan. 2020.
18. Brasil. Ministério da Ciência, Tecnologia e Inovação. Conferência Nacional de Ciência, Tecnologia e Inovação. Conferência realizada em setembro de 2001. Brasília: Ministério da Ciência e Tecnologia, 2001. Brasília: DF, 2001. Disponível em: [Link]. Acesso em: 07 jan. 2020.
19. Albuquerque EDM, Cassiolato JE. As especificações do sistema de inovação do setor saúde. Rev Econ Pol. 22(4): 2002. Disponível em: [Link]. Acesso em: 07 jan. 2020.
20. Brasil. Ministério da Ciência e Tecnologia. Livro Branco: Ciência, Tecnologia e Inovação / Brasília: Ministério da Ciência e Tecnologia, 2002. 80p. Resultado da Conferência Nacional de Ciência, Tecnologia e Inovação. ISBN: 85-88063-04-2. Disponível em: [Link]. Acesso em 07 jan. 2020.
21. CGEE. Centro de Gestão de Estudos Estratégicos. Avaliação de políticas de ciência, tecnologia e inovação: diálogo entre experiências internacionais e brasileiras. Brasília: Centro de Estudos Estratégicos, 2008. 249p.; II.; ISBN: 978-85-60755-10-3. Disponível em: [Link]. Acesso em: 07 jan. 2020.
22. Gadelha CAG, Quental C, Fialho BDC. Saúde e inovação: uma abordagem sistêmica das indústrias da saúde. Cad Saúde Públ. 2003; 19(1): 47-59. Disponível em: [CrossRef] [Link]. Acesso em 08 jan. 2020.
23. Gadelha CAG. O complexo industrial da saúde e a necessidade de um enfoque dinâmico na economia da saúde. Ciên Saúde Colet. 2003; 89(2): 521–535, Disponível em: [CrossRef] [Link]. Acesso em: 08 jan. 2020.
24. Alves FNR. Desafio para a inovação em fitomedicamentos no contexto da indústria farmacêutica nacional. Rev Fitos. 2005; 1(1):18-29. Disponível em: [Link]. Acesso em: 09 jan. 2020.
25. Villas Bôas G. Aspectos críticos na formulação política de um Sistema Nacional de Arranjos Produtivos Locais para o desenvolvimento de medicamentos de origem vegetal em cada bioma brasileiro. Rev Fitos. 2005; 1(02):25-29. Disponível em: [Link]. Acesso em: 10 jan. 2020.
26. Brasil. Ministério da Saúde. Secretaria-Executiva. Mais saúde: direito de todos: 2008-2011 / Ministério da Saúde, Secretaria-Executiva. 2ª ed. Brasília: Editora do Ministério da Saúde, 2008. 100p. (Série C. Projetos, Programas e Relatórios). Disponível em: [Link]. Acesso em: 11 jan. 2020. ISBN 978-85-334-1465-5.
27. Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Política nacional de ciência, tecnologia e inovação em saúde / Ministério da Saúde, Secretaria de Ciência, Tecnologia e Insumos Estratégicos, Departamento de Ciência e Tecnologia. 2ª ed. Brasília: Editora do Ministério da Saúde, 2008. 44 p. (Série B. Textos Básicos em Saúde). Disponível em: [Link]. Acesso em: 11 jan. 2020. ISBN: 85-334-1241-X.
28. Brasil. Ministério do Desenvolvimento, Indústria e Comércio Exterior. Diretrizes para a Política Industrial, Tecnológica e de Comércio Exterior. Brasília: Ministério do Desenvolvimento, Indústria e Comércio Exterior. p.23, 2003. Disponível em: [Link]. Acesso em: 11 jan. 2020.
29. Brasil. Ministério da Ciência, Tecnologia e Inovação. Ciência, Tecnologia e Inovação para o desenvolvimento nacional. Proposta da Estratégia Nacional de Ciência, Tecnologia e Inovação. Brasília, DF, 2015. Disponível em: [Link]. Acesso em: 11 jan. 2020.
30. IEDI. Instituto de Estudos para o Desenvolvimento Industrial. A política de desenvolvimento produtivo. Brasília: DF, 2008. Disponível em: [Link]. Acesso em: 11 jan. 2020.
31. Coutinho LG. Inovar e investir para sustentar o crescimento. BNDES. Banco Nacional do Desenvolvimento, 2014. Disponível em: [Link]. Acesso em: 12 jan. 2020.
32. Coutinho LG. Regimes macroeconômicos e estratégias de negócios: uma política industrial alternativa para o Brasil no século XXI. In: Lastres HMM, Cassiolato JE, Arroio A, organizadores. Conhecimento, sistemas de inovação e desenvolvimento. Rio de Janeiro: Contraponto; 2005. p. 429-48. ISBN: 978-8571082816.
33. Vargas M et al. Inovação na indústria química e biotecnológica em saúde: em busca de uma agenda virtuosa. Rev Saúde Públ. 2012; 46: 37-40. Disponível em: [CrossRef] [Link]. Acesso em: 15 jan. 2020.
34. Delgado IJG. Sistemas de atenção à saúde, Estado e inovação na indústria farmacêutica. Cad Saúde Publ. 2016; 32(Sup. 2). Disponível em: [CrossRef] [Link]. Acesso em: 15 jan. 2020.
35. Souza YP. Sínteses e aplicações recentes do Δ9-Tetraidrocanabinol (THC) e seus derivados em química medicinal. 32f. 2017. Monografia de Trabalho de Conclusão de Curso de Química [Coordenadoria do curso de química] Universidade Federal São-João-Del-Rei, 2017. Disponível em: [Link]. Acesso em: 15 jan. 2020.
36. Freeman AM et al. How does (CBD) influence the acute effects of delta-9-tetrahydrocannabinol (THC) in humans? A systematic review. Neurosci Biobehav Rev. 2019; 107:696-712. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 15 jan. 2020.
37. Atakan, Z. Cannabis, a complex plant: different compounds and different effects on individuals. Ther adv psychopharmacol. 2012; 2(6): 241-254. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 16 jan. 2020.
38. Li H. An archaeological and historical account of cannabis in China. Econ Botany. 1973; 28:437-448. Disponível em: [Link]. Acesso em: 16 jan. 2020.
39. Dewey, W. Cannabinoid pharmacology. Pharmacol Review. 1986; 38:151-178. Disponível em: [PubMed] [Link]. Acesso em: 17 jan. 2020.
40. Brenneisen R. Chemistry and analysis of Phyto cannabinoids and other cannabis constituents. Marijuana and the cannabinoids, capítulo 2, 17-49, 2007. Disponível em: [Link]. Acesso em: 18 jan. 2020.
41. Pertwee RG, Cascio MG. Known pharmacological actions of delta-9-tetrahydrocannabinol and of four other chemical constituents of cannabis that activate cannabinoid receptors. In: Pertwee RG. (Ed.), Handbook of Cannabis Oxford University Press, UK. 2014; 115p. Disponível em: [Link]. Acesso em: 18 jan. 2020.
42. Colizzi M, Bhattacharyya S. Cannabis use and the development of tolerance a systematic review of human evidence. Neurosci BiobehavRev. 2018; 93:1-25. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 18 jan. 2020.
43. Pertwee RG. The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Δ-9 tetrahydrocannabinol, cannabidiol and Δ-9 tetrahydrocannabivarin. Br J Pharmacol.2008; 153(2):199-215. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 18 jan. 2020.
44. Thomas A, Baillie GL, Phillips AM, Razdan RK, Ross RA, Pertwee RG et al. Cannabidiol displays unexpectedly high potency as an antagonist of CB1 and CB2 receptor agonists in vitro. Br J Pharmacol. 2007; 150(5):613-623. Disponível em: [CrossRef ] [PubMed] [Link]. Acesso em: 18 jan. 2020.
45. Ben-Shabat S, Fride E, Sheskin T, Tamiri T, Rhee MH, Vogel Z et al. An entourage effect: inactive endogenous fatty acid glycerol esters enhance 2-arachifonoyl-glycerol cannabinoid activity. Eur J Pharmacol. 1998; 353(1):23-31. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 18 jan. 2020.
46. King KM, Myers AM, Soroka‐Monzo AJ, Tuma RF, Tallarida RJ, Walker EA et al. Single and combined effects of 19-tetrahydrocannabinol and cannabidiol in a mouse model of chemotherapy-induced neuropathic pain. Br J Pharmacol. 2017; 174:2832-41. Disponível em: [CrossRef ] [PubMed] [Link]. Acesso em: 18 jan. 2020.
47. KarnioL IG, Carlini EA. Pharmacological interaction between cannabidiol and delta 9-tetrahydrocannabinol. Psychopharmacol. 1973; 33:53-70. Disponível em: [PubMed]. Acesso em: 18 jan. 2020.
48. Borges DCL, Ugá MAD. Conflitos e impasses da judicialização na obtenção de medicamentos: as decisões de 1a instância nas ações individuais contra o Estado do Rio de Janeiro, Brasil, em 2005. Cad Saúde Púb. 2011; 26(1): 59-69. Disponível em: [CrossRef] [PubMed] [Link]. Acesso em: 18 jan. 2020.
49. Brasil. Constituição da República Federativa do Brasil: promulgada em 5 de outubro de 1988. Disponível em: [Link]. Acesso em: 18 jan. 2020.
50. Brasil. Lei Federal nº 8.080, de 19 de setembro de 1990. Lei Orgânica da Saúde. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. Diário Oficial [da] República Federativa do Brasil. Brasília: DF, 1990. Disponível em: [Link]. Acesso em: 19 jan. 2020.
51. Brasil. Ministério da Saúde. Secretaria de Políticas de Saúde. Departamento de Atenção Básica. Política Nacional de Medicamentos 2001/Ministério da Saúde, Secretaria de Políticas de Saúde, Departamento de Atenção Básica. Brasília: Ministério da Saúde, 2001. Disponível em: [Link]. Acesso em: 19 jan. 2020.
52. WHO Expert Committee on the Selection of Essential Drugs, 17-21 October 1977 - WHO Technical Report Series, Nº 615 (1st WHO Model List of Essential Medicines). Disponível em: [Link]. Acesso em: 19 jan. 2020.
53. Ventura M, Simas L, Pepe VLE, Schramm FR. Judicialização da saúde, acesso à justiça e a efetividade do direito à saúde. Physis [online]. 2010; 20(1): 77-100. ISSN 0103-7331. Disponível em: [CrossRef] [Link]. Acesso em: 19 jan. 2020.
54. Brasil. Ministério da Saúde. Conselho Nacional de Saúde. Resolução n° 388, de 06 de maio de 2004. Conselho Nacional de Saúde. Brasília, DF, 2004. Disponível em: [Link]. Acesso em: 19 jan. 2020.
55. Brasil. Agência Nacional da Vigilância Sanitária. Resolução da Diretoria Colegiada, RDC n° 17, de 06 de maio de 2015. Define os critérios e os procedimentos para a importação, em caráter de excepcionalidade, de produto à base de Canabidiol em associação com outros canabinóides, por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde. Brasília, DF, 2015. Disponível em: [Link]. Acesso em: 19 jan. 2020.
56. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Pedido de importação do Canabidiol por excepcionalidade aumenta [Online]. Disponível em: [Link]. Acesso em: 16 jan. 2020.
57. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Passo a passo para importação de produtos à base de Canabidiol [Online]. Disponível em: [Link]. Acesso em 17 jan. 2020.
58. Brasil. Agência Nacional de Vigilância Sanitária. Nota Técnica nº 093/2015-CPCON/GGFIS/SUCOM. Orientações para a aquisição intermediada de produtos à base de Canabidiol em associação com outros canabinóides para pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde. Brasília, 28 de setembro de 2015. Disponível em: [Link]. Acesso em: 17 jan. 2020.
59. Brasil. Ministério da Saúde. Secretaria de Vigilância Sanitária. Portaria n° 344, de 12 de maio de 1998. Aprova o regulamento técnico sobre substâncias e medicamentos sujeitos a controle especial. Diário Oficial da República Federativa do Brasil. Brasília, 31 de dez. de 1998.
60. Brasil. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada, RDC n° 126, de 02 de dezembro de 2015. Dispõe sobre a atualização do Anexo I (Produtos à base de Canabidiol em associação com outros canabinóides, dentre eles o THC, em conformidade com o capítulo I - seção II da Resolução da Diretoria Colegiada - RDC nº 17, de 6 de maio de 2015. Brasília, DF, 2015. Disponível em: [Link]. Acesso em: 18 jan. 2020.
61. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Agenda Regulatória 2017-2020 [Online]. Disponível em: [Link]. Acesso em 17 jan. 2020.
62. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Registrado o primeiro medicamento à base de Cannabis medicinal no Brasil [Online]. Disponível em: [Link]; Acesso em: 17 jan. 2020.
63. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Maconha: ANVISA não é contra uso para fins medicinais [Online]. Disponível em: [Link]. Acesso em: 16 Dez. 2019.
64. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada, RDC n° 156, de 05 de maio de 2017. Dispõe sobre a alteração das Resoluções da Diretoria Colegiada - RDC nº 64/2012, nº 29/2013, nº 42/2014, nº 01/2015, nº 11/2015, nº 71/2016 e nº 104/2016, para a inclusão, alteração e exclusão de Denominações Comuns Brasileiras - DCB, na lista completa das DCB da ANVISA. Brasília, DF, 2017. Disponível em: [Link]. Acesso em: 20 jan. 2020.
65. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Proposta de Consulta Pública n° 654, de 14 de junho de 2019, que dispõe sobre o monitoramento de medicamentos à base de Cannabis sp., seus derivados e análogos sintéticos. Brasília: DF, ANVISA. 2019. Disponível em: [Link]. Acesso em: 20 jan. 2020.
66. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Proposta de Consulta Pública n° 655, de 14 de junho de 2019, que dispõe sobre a proposta de requisitos técnicos e administrativos para o cultivo da planta Cannabis sp., para fins medicinais e científicos, e dá outras providências. Brasília: DF, ANVISA. 2019. Disponível em: [Link]. Acessado em 20 jan. 2020.
67. Brasil. ANVISA. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada, RDC n° 327, de 11 de dezembro de 2019. Dispõe sobre os procedimentos para a concessão da autorização sanitária para a fabricação e a importação, bem como estabelece requisitos para comercialização, prescrição, dispensação, monitoramento e fiscalização de produtos derivados da Cannabis para fins medicinais. Brasília, DF, ANVISA, 2019. Disponível em: [Link]. Acesso em: 20 jan. 2020.
68. Laffin NHF, Bonacim CAG. Custos da saúde: judicialização de medicamentos ofertados pelo SUS. Anais do XXVI Congresso Brasileiro de Custos. Curitiba: PR. 2019. Disponível em: [Link]. Acesso: em 20 jan. 2020.
69. Brasil. Emenda Constitucional nº 95, de 15 de dezembro de 2016. Altera o Ato das Disposições Constitucionais Transitórias para instituir o Novo Regime Fiscal e dá outras providências. Disponível em: [Link]. Acesso em: 20 jan. 2020.
70. Casas CNPR. O complexo industrial da saúde na área farmacêutica: uma discussão sobre inovação e acesso no Brasil. Tese de Dourado [Escola Nacional de Saúde Pública – ENSP] FIOCRUZ, 216p. 2009. Disponível em: [Link]. Acesso em: 20 jan. 2020.
71. Cassiolato JE, Brito J, Vargas M. Arranjos Cooperativos e Inovação na Indústria Brasileira. In: De Negri JA, Salerno MS. Inovações, Padrões Tecnológicos e Desempenho das Firmas Industriais Brasileiras. Brasília: IPEA, 2005. Disponível em: [Link]. Acesso em: 20 jan. 2020.
72. Brasil. Lei de Inovação Tecnológica (Lei n.º 13.243/16). Brasília, DF: Congresso Nacional. Atos do Poder Legislativo, D.O.U, n.º 232 de 03.12.2004. Disponível em: [Link]. Acesso em: 20 jan. 2020.
73. Brasil. Lei de Inovação Tecnológica (Lei n.º 10.973/2004). Brasília, DF: Congresso Nacional. Atos do Poder Legislativo D.O.U, n.º 232 de 03.12.2004. Disponível em: [Link]. Acesso em: 20 jan. 2020.
74. Brasil. Casa Civil. Portaria n° 2.531, de 12 de novembro de 2014, que redefine as diretrizes e os critérios para a definição da lista de produtos estratégicos para o Sistema Único de Saúde (SUS) e o estabelecimento das Parcerias para o Desenvolvimento Produtivo (PDP) e disciplinam os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS no âmbito das PDP e o respectivo monitoramento e avaliação. Brasília, DF: Congresso Nacional. Atos do Poder Legislativo, D.O.U, 2014. Disponível em: [Link]. Acesso em: 20 jan. 2020.