Artigo de Pesquisa
Toxicidade oral aguda e avaliação dos efeitos pressóricos e renais causados pela oncocalyxona A
Acute oral toxicity and assessment of blood pressure and kidney effects caused by oncocalyxone A
Resumo
Neste estudo propõe-se avaliar os efeitos toxicológicos, pressóricos e renais da onco-A em modelos animais in vivo e ex vivo. A Oncocalyxona A (onco-A) isolada de Auxemma oncocalyx foi estudada nas doses 1, 3, e 10 µg/mL. Utilizou-se camundongos Swiss fêmeas (20-25g) para o teste de toxicidade oral aguda. Os dados foram comparados por teste t de Student, Two-Way ANOVA e pós-teste de Bonferroni (p<0,05). Foi estimado uma DL50 ˃ 2000 mg/kg, os tecidos pulmonar, renal e cardíaco demonstraram alterações histológicas. Sobre os níveis pressóricos de ratos, a onco-A ocasionou redução significativa da pressão arterial média, alterou os níveis de creatinina e, observou-se alterações histológicas nos tecidos cardíaco e renal. Em perfusão de rim isolado a onco-A causou aumento na pressão de perfusão, fluxo urinário e resistência vascular renal. O ritmo de filtração glomerular encontrou-se reduzido nas concentrações de 1 µg/mL e 10 µg/mL e aumentado para a dose de 3 µg/mL. As fotomicrografias do tecido renal após a perfusão demonstraram alterações histológicas significativas induzidas pela onco-A. Pode-se inferir que, embora a onco-A tenha apresentado baixa letalidade em todos os protocolos experimentais realizados, mostrou evidências de toxicidade pulmonar, renal e cardíaca.
- Palavras-chave:
- Oncocalyxona A.
- Toxicidade oral aguda.
- Perfusão renal.
- Alterações histológicas.
Abstract
This study proposes to evaluate the toxicological, pressure and renal effects of onco-A in animal models in vivo and ex vivo. The Oncocalyxone-A (onco-A), isolated of Auxemma oncocalyx, was studied in doses of 1, 3 and 10 µg/mL. Female Swiss mice were used (20-25g) for the acute oral toxicity test. The data were compared by test t de Student, Two-Way ANOVA and post-test Bonferroni (p<0,05). The oral toxicity was considered low since it showed a DL50 ˃ 2000 mg/kg. Histological alterations on lung, renal and cardiac tissues were observed. About levels blood pressure of rats, the onco-A caused a significant reduction of mean arterial pressure, altered creatinine levels and, histological changes in cardiac and renal tissues. In isolated kidney perfusion onco-A caused an increase in perfusion pressure urinary flow and renal vascular resistance. The rate of glomerular filtration was reduced in concentrations 1 µg /mL and 10 µg/mL increasing the dose to 3 μg / mL. Photomicrographs of renal tissue after perfusion demonstrated significant histological changes induced by onco-A. It can be inferred that, although onco-A has presented low lethality in all experimental protocols performed, showed evidence of pulmonary, renal and cardiac toxicity.
- Keywords:
- Oncocalyxone-A.
- Acute oral toxicity.
- Renal perfusion.
- Histological changes.
Introdução
O interesse em substâncias naturais para o tratamento de enfermidades vem crescendo com o passar dos anos, mesmo com a existência de propriedades tóxicas de muitas dessas substâncias[1], dada a diversidade e potencialidade delas em diversos relatos de uso popular, como doenças dos sistemas cardiovascular e renal.
Neste sentido, a mensuração da pressão arterial é de extrema importância para uma avaliação inicial e estimativa útil do estado cardiovascular[2]. Algumas classes de fármacos atualmente disponíveis no mercado, como alguns agentes quimioterápicos, apresentam como efeito adverso cardiotoxicidade e, por vezes, seu uso tem restrição em pacientes com desordens pressóricas[3].
Em relação ao sistema renal, uma das manifestações mais comuns de dano nefrotóxico é a Lesão Renal Aguda (LRA), caracterizada por um abrupto declínio da função renal por redução da taxa de filtração glomerular (TFG), levando a um aumento dos níveis séricos de compostos nitrogenados, como ureia e creatinina, e de resíduos de hidrogênio[4].
Na busca por substâncias que possam ser utilizadas para estas duas situações e, tendo em vista, que a química dos produtos naturais tem ganhado grande notoriedade nos últimos anos[5], optou-se pelo estudo da ação de quinonas em um modelo animal que pudesse predizer a ação destes compostos.
As quinonas são consideradas uma importante classe de produtos naturais, sendo encontradas abundantemente na natureza, como em plantas, fungos, bactérias e artrópodes[6,7]. As cadeias hidrofóbicas desses compostos permitem sua ligação a membranas celulares e proteínas, e suas estruturas de anéis conjugados precisam ser reduzidas para se tornarem mais estáveis, funcionando como moléculas aceptoras de elétrons [8].
Ao longo da história, vários outros benefícios medicinais têm sido acrescidos à classe, como propriedades antibiótica, antitumoral, antiparasitária, anticoagulante, dentre outras[7]. Dentre os fármacos com propriedades anticâncer, as quinonas representam uma das maiores classes de agentes antitumorais com fortes candidatos para uso clínico[9]. Entretanto, o grande inconveniente destes compostos, como a maioria dos quimioterápicos, está relacionado a citotoxicidade direcionada apenas às células cancerígenas, o que limita o avanço de muitas pesquisas[10].
Auxemma oncocalyx TAUB. (onco-A) pertencente à família Boraginaceae e apresenta, em sua composição, diversas quinonas. Conhecida popularmente como pau branco, a árvore é característica da Caatinga, no nordeste brasileiro, onde apresenta distribuição mais expressiva no estado do Ceará[11]. Os efeitos biológicos dessas quinonas têm sido extensivamente estudados, e descritos em atividades antiedematogênica e analgésica[12], antidiabética[13] e antiagregante plaquetária[14]. Os principais estudos desta substância se destacam na área da oncologia, por apresentar atividade antiproliferativa em linhagens de células tumorais[15], onde sua atividade citotóxica está relacionada a dano direto ao DNA e morte celular por apoptose[16].
A ausência de dados toxicológicos in vivo, a possibilidade de utilização da onco-A na terapêutica anticâncer, bem como o conhecimento sobre a toxicidade de compostos da mesma classe química, foram os fatos principais que motivaram a execução deste trabalho. O presente estudo se propõe avaliar os efeitos toxicológicos, pressóricos e renais da onco-A em modelos animais in vivo e ex vivo.
Materiais e Métodos
A onco-A foi isolada por cromatografia em gel de sílica a partir do extrato etanólico do cerne do caule da A. oncocalyx. A preparação do extrato, o método de isolamento e a caracterização química foram descritas por Pessoa et al.[17,18].
Para o teste de toxicidade oral aguda foram utilizados camundongos Swiss fêmeas (pesando entre 20 a 25 g), em que foi possível a determinação de uma dose de segurança para a realização dos experimentos de pressão arterial média e perfusão renal ratos Wistar machos (250-300 g), provenientes do Biotério do Departamento de Fisiologia e Farmacologia da UFC. Todos os experimentos foram realizados de acordo com o Comitê de Ética no Uso de Animais (CEUA) da Universidade Federal do Ceará sob o número 32/15.
Inicialmente, camundongos swiss (n=6) receberam uma dose de 2000 mg/Kg de onco-A por uma cânula de gavagem em um volume de 2 mL/Kg. Após a administração de cada dose, os animais foram observados por 15, 30 e 60 minutos bem como após 24 horas e, diariamente, por um total de 14 dias, quanto a presença de sinais indicativos de toxicidade. A variação de peso corporal foi registrada. Ao final do experimento os animais foram anestesiados com cetamina (80 mg/Kg) e xilasina (10 mg/Kg) para coleta de sangue venoso para posteriores análises bioquímicas (ureia, creatinina e ácido úrico); bem como para a retirada dos órgãos (rim, coração e pulmão) para análise histológica.
Após a verificação de baixa toxicidade, ratos Wistar machos (n=6), pesando entre 250-300 g, foram anestesiados com cetamina (100 mg/Kg) e xilazina (10 mg/Kg) para a realização do procedimento cirúrgico, que consistiu de uma traqueostomia e implantação de cateteres preenchidos com heparina (500 UI. mL-1 em salina) na aorta abdominal para registro da Pressão Arterial Média e na veia cava inferior para administração de drogas, conforme técnica descrita previamente[19,20]. O cateter aórtico foi então acoplado a um transdutor de pressão piezo-elétrico (Braile BXSN) e a um sistema de amplificação de sinal com interface USB (DATAQ DI-148U), utilizando o software de aquisição de dados WinDaq/Lite para o cálculo direto da P.A.M. A onco-A foi injetada manualmente in bolus no volume de 0,1 mL, seguido de injeção de 0,2 mL de solução salina. Cada animal recebeu uma série crescente de doses da onco-A (30, 100, 300 e 1000 µg/Kg) através do cateter intravenoso em intervalos de 5 minutos cada, e o curso temporal das alterações de pressão arterial média foi registrado. Após o período experimental foi realizada a eutanásia do animal por exsanguinação e laparotomia transversal e longitudinal para coleta de sangue e órgãos (coração e rim). Alíquotas de sangue venoso foram coletadas para a realização de dosagens bioquímicas de aspartato transaminase (AST), alanina aminotransferase (ALT), lactato desidrogenase, creatina quinase (CK-Total), creatinina, ureia e ácido úrico.
Para análise da função renal foi utilizado o sistema de perfusão de órgão[21,22]. Este sistema permite a manutenção constante de parâmetros funcionais renais com utilização de albumina bovina à 6% na solução perfusora de Krebs-Henseleit e oxigenação por mistura carbogênica (95% de oxigênio e 5% de CO2). A técnica cirúrgica utilizada seguiu o método descrito por Balhlmann et al.[23], Nishiitsutji-Uwo et al.[24] , Ross[25] e Fonteles et al.[21]. Ratos Wistar machos (n=6) pesando entre 250-300 g foram anestesiados cetamina (100 mg/Kg) e xilazina (10 mg/Kg) e o rim direito colocado no sistema. Foram registrados a pressão de perfusão e o fluxo de perfusão a cada cinco minutos, durante 120 min. Amostras de urina e perfusato foram coletadas para posterior dosagem de sódio, potássio, cloreto (método íon eletrodo seletivo - RapidChem 744 - Bayer® diagnóstica), inulina (hidrólise direta, conforme Walser et al.[26] e Fonteles et al.[21] e osmolaridade (osmômetro de vapor – Vapro®), importantes no cálculo dos parâmetros da função renal. As concentrações de onco-A utilizadas foram 1 g/mL, 3 µg/mL e 10 µg/mL, para fins de comparação dos efeitos da substância sobre a pressão de perfusão (PP), resistência vascular renal (RVR), ritmo de filtração glomerular (RFG), fluxo urinário (FU) e transporte de eletrólitos (Na+, K+ e Cl-). Ao final da perfusão, os rins foram pesados e, em seguida, amostras de tecido foram armazenadas em 10% de formalina tamponada durante 24 h, seguido de etanol (70%). Os fragmentos foram submetidos a desidratação, diafanização e corte a uma espessura de 5μm. As lâminas foram coradas com hematoxilina-eosina (HE) e analisadas utilizando um microscópio óptico trinocular Nikon Eclipse.
Para análise estatística, todos os dados foram expressos como média ± erro padrão da média e analisados através do programa GraphPadPrism v. 6.0. Utilizou-se os testes estatísticos (ANOVA e Teste t de Student) para analisar os experimentos de pressão arterial. Para as dosagens bioquímicas realizadas nos experimentos de Toxicidade Oral Aguda e de Pressão arterial média, os resultados foram analisados utilizando Teste t de Student. Nos ensaios de perfusão renal, utilizou-se Two-Way ANOVA, seguida de pós-teste de Bonferroni.
Resultados e Discussão
Onco-A na dose de 2000 mg/Kg foi administrada por gavagem ao primeiro animal e verificada a sobrevivência após 48 h (Animal 1). Diante deste resultado foram realizados testes em mais 3 animais. Os Animais 2 e 3 sobreviveram aos 14 dias da administração, ao passo que o Animal 4 morreu cerca de 2 h e 30 min após a gavagem. Destacando-se que, desses animais, três consecutivos sobreviveram no teste da dose limite, de 2000 mg/Kg, estima-se uma DL50 ˃ 2000 mg/Kg. É importante ressaltar que durante os 14 dias após a administração, os animais que sobreviveram não apresentaram nenhuma outra alteração indicativa de toxicidade.
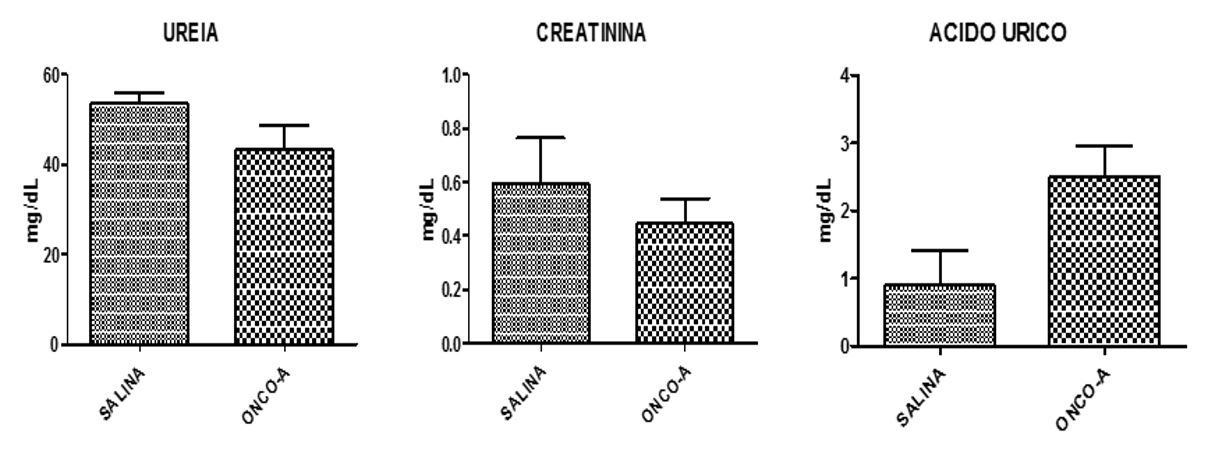
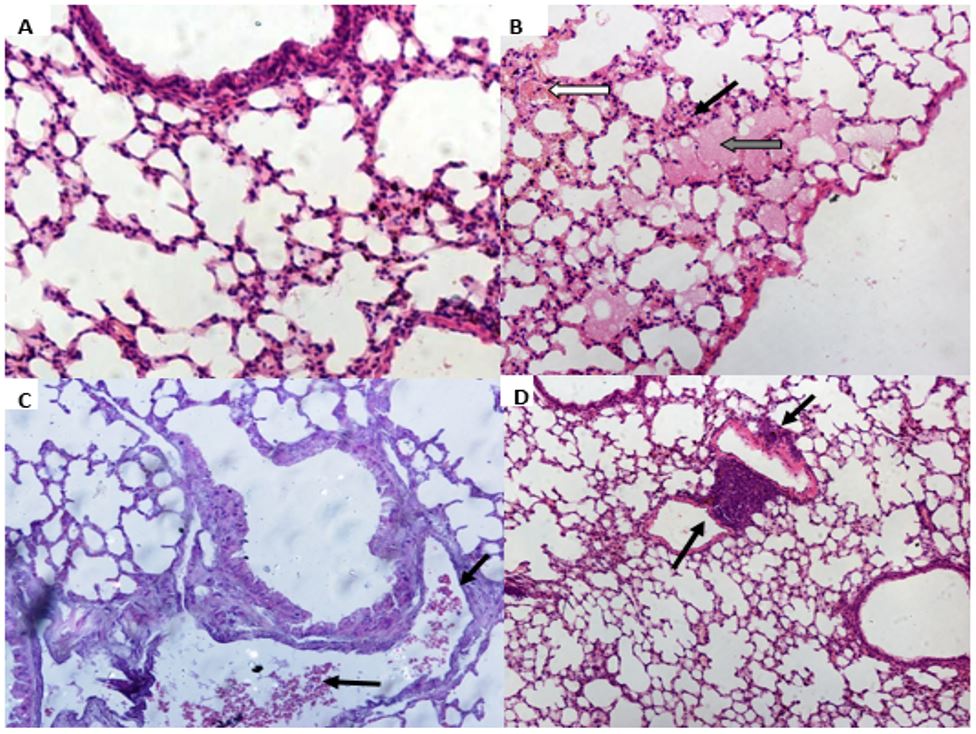
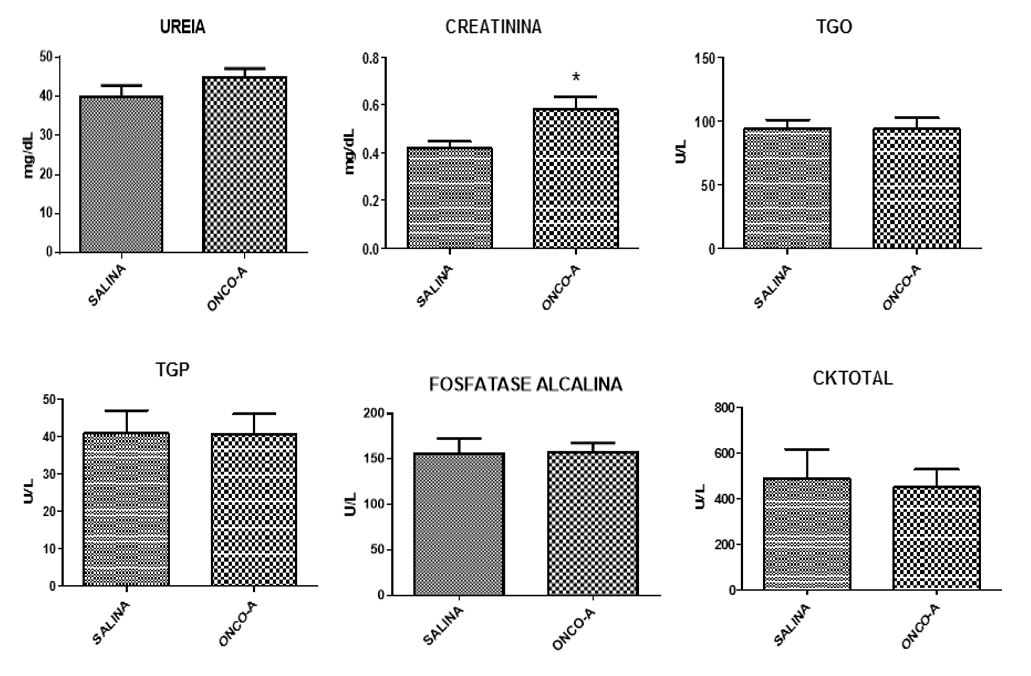
Ao final do período, verificou-se que o tratamento com onco-A não provocou alterações estatisticamente significativas sobre as dosagens bioquímicas de ureia, creatinina e ácido úrico (FIGURA 1). Entretanto, na análise histológica dos tecidos pulmonar, renal e cardíaco demonstraram diversas alterações. No tecido pulmonar observou-se hemorragia, infiltrado inflamatório, edema, hiperplasia do tecido linfoide, hemorragia intra-alveolar. Em relação ao tecido renal, foram observadas alterações tais como: degeneração glomerular e degeneração tubular hidrópica, com tumefação das células tubulares; atrofia glomerular e depósito de material proteico na luz tubular. No tecido cardíaco foram observados presença de vasos sanguíneos congestos, área de necrose, com destaque para as células anucleadas e eosinofílicas; infiltrado inflamatório, edema e células necróticas. No grupo controle não houve qualquer indício de citotoxicidade (FIGURAS 2, 3 e 4).
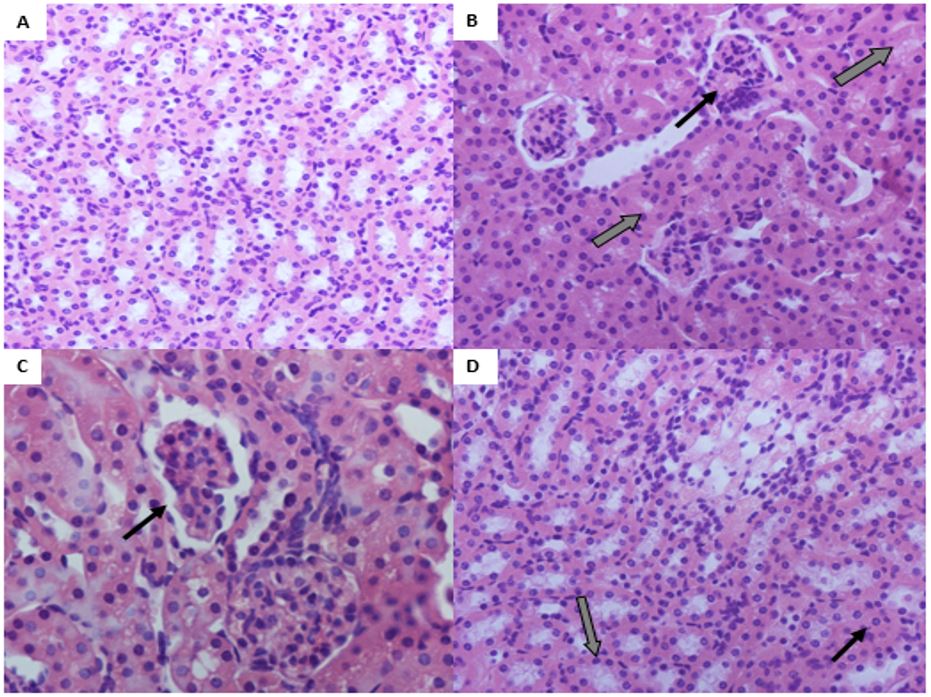
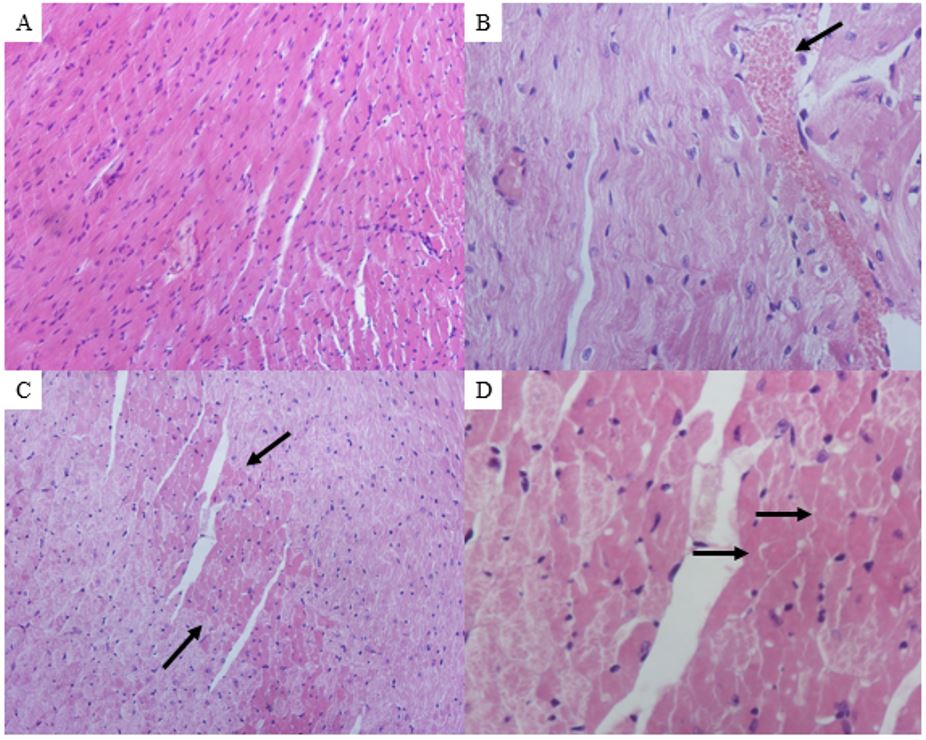
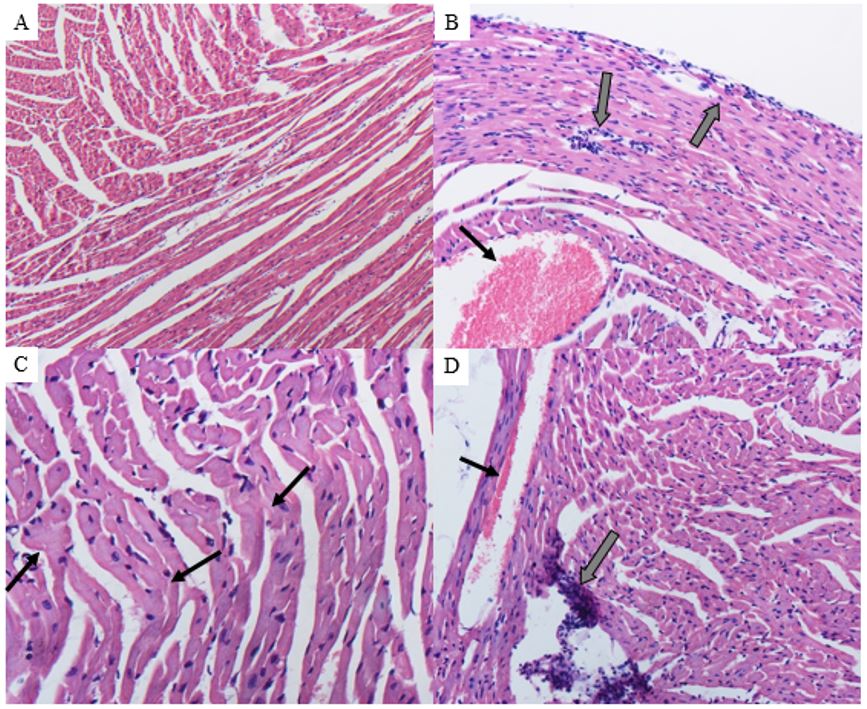
Ao analisar as fotomicrografias referentes aos tecidos cardíaco e renal, foram observadas alterações após o protocolo experimental de pressão arterial média. No tecido cardíaco observou-se hemorragia, infiltrado inflamatório, área necrosante, presença de vasos sanguíneos congestos e infiltrado inflamatório no pericárdio (FIGURA 7). As alterações no tecido renal, induzidas pela onco-A foram degeneração tubular hidrópica tubular, depósito de material proteico na luz tubular, presença de vaso sanguíneo congesto, edema intersticial, degeneração tubular e infiltrado inflamatório moderado na região periglomerular (FIGURA 8). No grupo controle não houve alterações nos tecidos correspondentes.
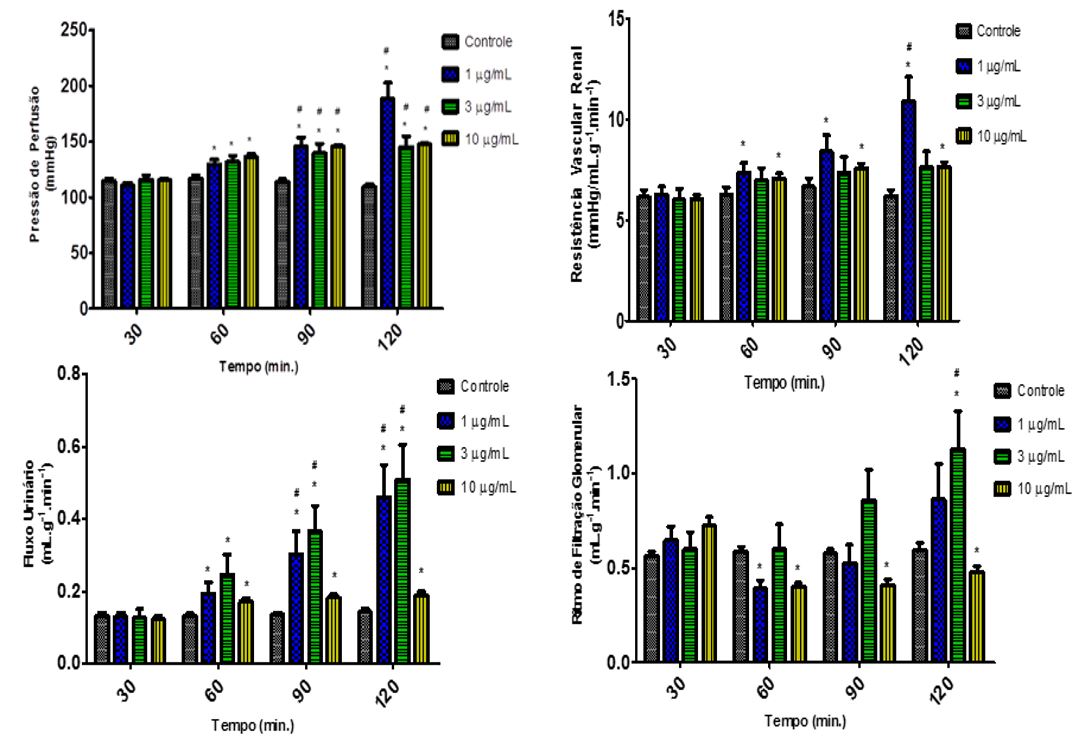
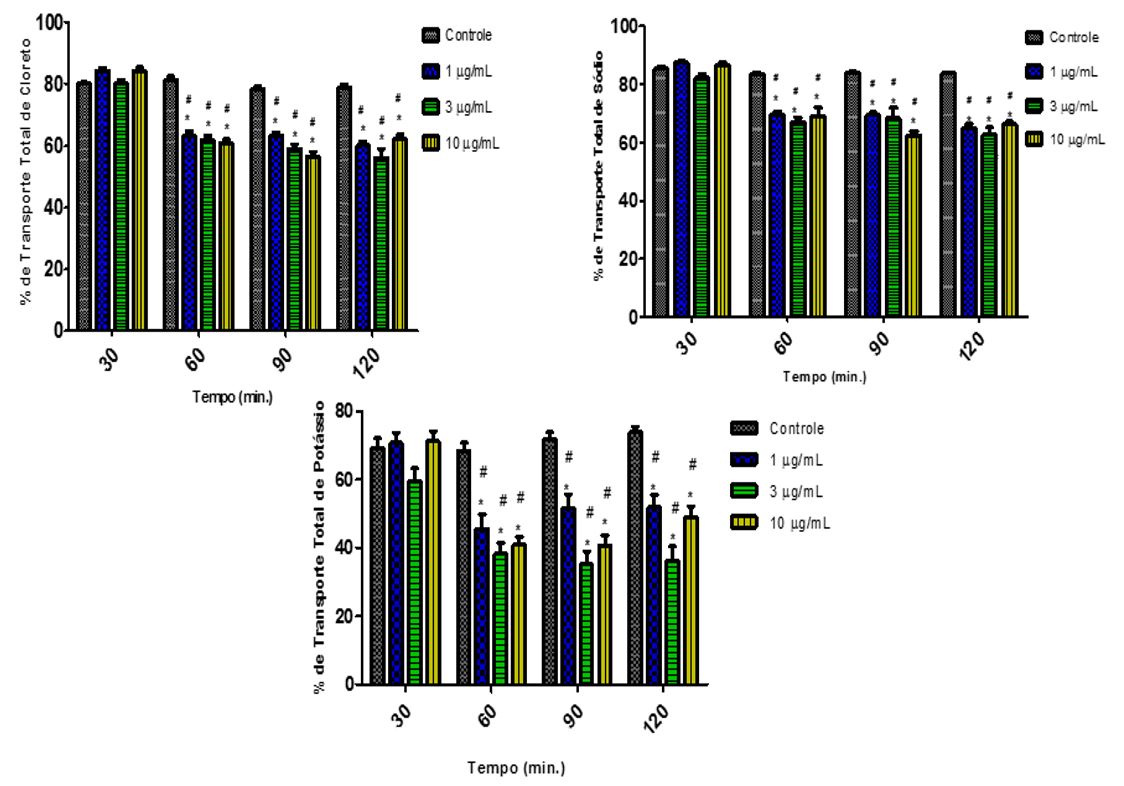
Quando avaliados os dados resultantes da perfusão renal após a administração da onco-A, foram observadas alterações na fisiologia renal nos parâmetros avaliados. Pode-se observar um aumento na PP aos 60, 90 e 120 minutos nos grupos das três doses estudadas quando comparadas ao grupo controle interno (FIGURA 9). Esses resultados foram acompanhados do aumento significativo da RVR para as doses de 1 µg/mL e 10 µg/mL nos tempos 60, 90 e 120 (FIGURA 9). Para a dose de 3 µg/mL não houve alteração estatisticamente significante. Em relação ao FU, a onco-A promoveu aumento significativo nos tempos de 60, 90 e 120 minutos para os três grupos (FIGURA 9). Já o RFG, na comparação com o controle interno, encontrou-se reduzido nas concentrações de 1 µg/mL (tempo 90) e 10 µg/mL (tempos 60, 90 e 120) e aumentada para a dose de 3 µg/mL, no último tempo (FIGURA 9). Em relação ao Transporte Tubular Total dos eletrólitos (Na+, K+ e Cl-), houve redução significativa em todos os tempos do experimento nos três grupos estudados (FIGURA 10).
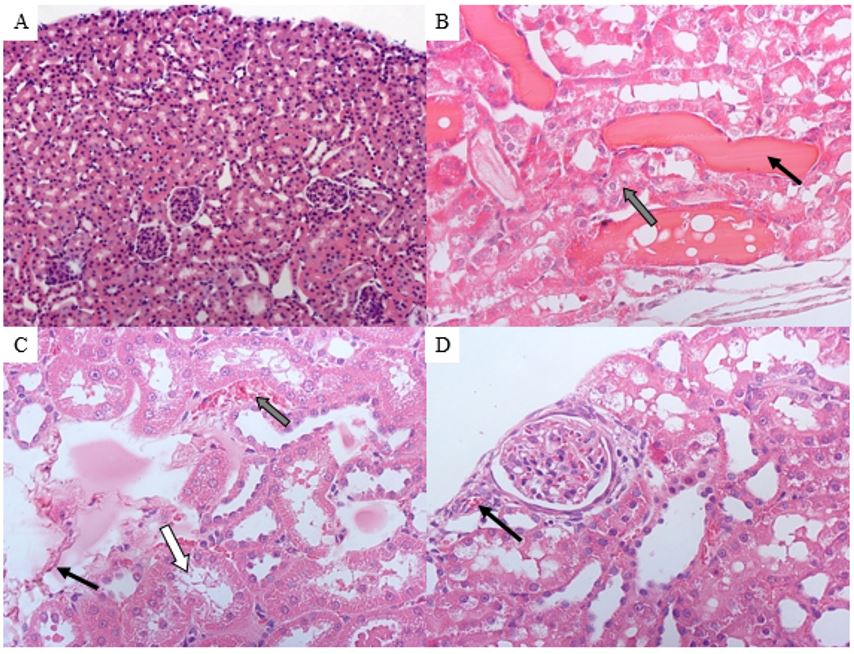
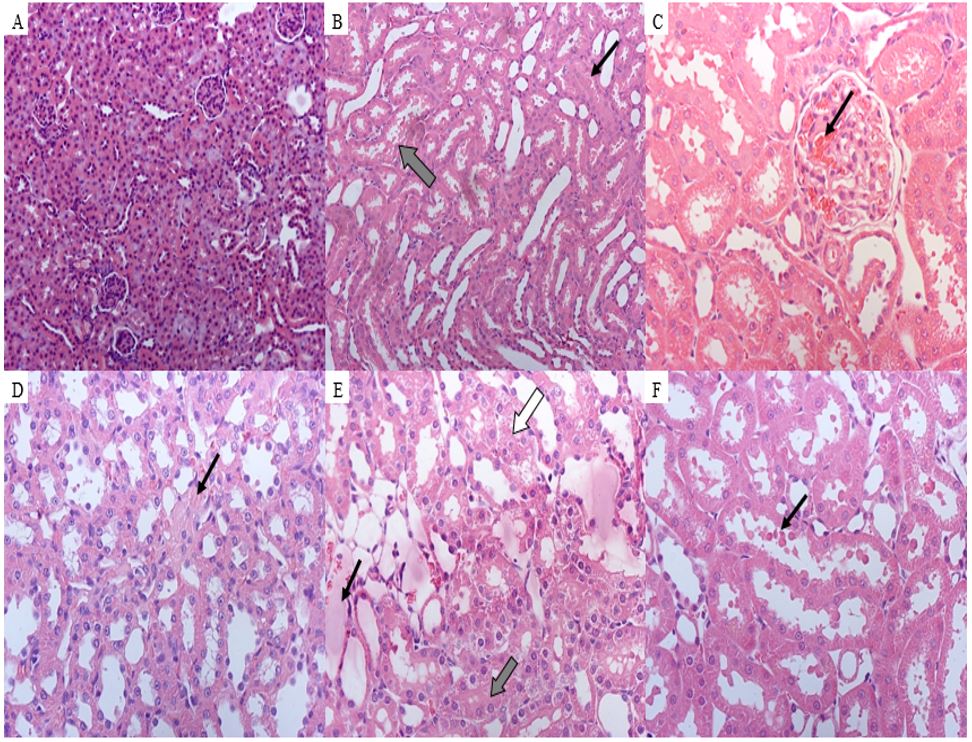
Ao analisar as fotomicrografias do tecido renal após a perfusão, foram observadas alterações induzidas pela onco-A, tais como: degeneração tubular, depósito de material proteico na luz tubular, congestão glomerular, fibrose intersticial discreta, edema peritubular e presença de hemácias no lúmen tubular (FIGURA 11).
Estudos toxicológicos têm a finalidade de assegurar ou refutar a aplicabilidade clínica de um fármaco para investigação de sua segurança, o que se dá através de testes para avaliação de efeitos agudos ou crônicos, sistêmicos ou sítio-específicos[27]. Com base neste entendimento foi investigada a toxicidade oral aguda da onco-A, para determinação de sua DL50. No teste da dose limite, a onco-A apresentou uma DL50 > 2000 mg/Kg, em virtude da sobrevivência de três animais, indicando ser uma substância de baixa letalidade.
Sivagnanam et al.[13] em um estudo para investigação da atividade antidiabética da onco-A isolada da planta Prenanthes sarmantosus, administrou por via oral 200 mg/Kg da substância em camundongos não diabéticos (n=12), também não relando toxicidade elevada da substância.
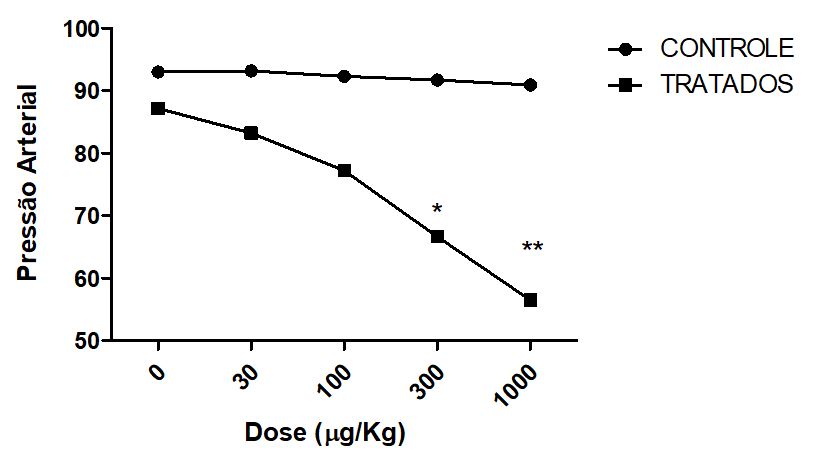
Na avaliação dos efeitos pressóricos sistêmicos, verificou-se que a onco-A promoveu redução na pressão arterial média de ratos normotensos anestesiados. Estudos realizados com a para-benzoquinona, um metabólito do benzeno, verificaram que altas doses da substância induziram decréscimo na pressão arterial e morte devido a paralisia no centro medular[28]. A hipoperfusão renal ocasionada pela hipotensão, poderia explicar o aumento transitório significativo dos níveis de creatinina plasmática nos animais tratados com onco-A submetidos ao protocolo de pressão arterial média[29].
O tratamento com onco-A resultou em dano na arquitetura microscópica glomerular e tubular, bem como em infiltração de células inflamatórias na análise histológica do tecido renal dos animais submetidos aos experimentos in vivo de toxicidade oral aguda e pressão arterial média. Devido ao alto metabolismo basal e ao seu papel no processo de detoxificação de substâncias, os rins são particularmente sensíveis ao estresse oxidativo induzido por quinonas. EROs tem grande importância como mediadores da sinalização intracelular relacionado aos processos de necrose e apoptose, e a perda de função celular, envolvidos no dano glomerular e tubular. Em resposta ao dano direto tubular induzido por nefrotoxicantes, as células epiteliais tubulares sofrem uma rápida perda da integridade do citoesqueleto e de sua polaridade, caracterizado por dilatação e degeneração celular, perda da borda em escova, bem como processos de necrose ou apoptose[30].
As demais alterações histológicas após 14 dias, indicaram pronunciados sinais de toxicidade causados pela onco-A, com destaque para a presença de hemorragia alveolar e infiltrado inflamatório no tecido pulmonar, além de áreas de necrose, infiltrado inflamatório, edema e congestão vascular, na análise do tecido cardíaco. Isso se deve, provavelmente, à presença de antraquinonas como a doxorrubicina, daunorrubicina e epirrubicina[31] que estão relacionadas ao desenvolvimento de cardiotoxicidade através da formação de EROs (O2- e H2O2), por meio de reações no ciclo redox, ou pela formação de complexos com proteínas do metabolismo do ferro[32].
Quando o efeito da onco-A é avaliado sobre o órgão isolado (rim), percebe-se uma elevação na PP aumentou nas três concentrações testadas de Onco-A, com incremento da resistência (RVR) nas concentrações de 1 μg/mL e 10 μg/mL. Pode-se, então, inferir que a diminuição da pressão sistêmica evidenciada nos experimentos de pressão arterial média, pode estar influenciando a arquitetura renal, de forma a alterar os capilares renais, causando vasoconstricção arteriolar e elevando a pressão de perfusão e resistência renal[33]. Isso pode ser corroborado, ainda, pela complexidade do sistema renal, que é controlado por milhares de vias de sinalização endócrinas, bem como pelo potencial tóxico da onco-A em causar dano direto ao DNA da célula, levando a diferentes repostas fisiológicas, em diferentes sistemas.
Os resultados de redução do transporte de eletrólitos, bem como o aumento da diurese induzido pela onco-A nas três concentrações testadas sugere uma ação tubular associada. Os achados histológicos de degeneração hidrópica tubular e edema peritubular nos rins perfundidos com onco-A, corroboram com esses resultados. A perda de polaridade das células com borda em escova do túbulo proximal, leva a uma instabilidade funcional das proteínas transportadoras presentes na membrana da célula tubular, o que resulta diretamente na redução dos transportes iônicos. A degeneração hidrópica é ocasionada em virtude de uma maior retenção de eletrólitos no citoplasma das células tubulares, por uma diminuição da reabsorção tubular[34]. A maior retenção de solutos nos túbulos renais explica o aumento do volume urinário, devido à maior concentração de solutos na urina[35].
Um dos parâmetros mais importantes para a avaliação da função renal é o RFG. Este diminuiu transitoriamente nos rins perfundidos com onco-A 1 µg/mL, apresentou aumento no grupo de concentração 3 µg/mL, e redução irreversível com 10 µg/mL de onco-A. Nguyen et al.[36] em um estudo com compostos derivados de quinonas (AA-861, tBuBHQ, tBuBQ, eduroquinona), detectou que os compostos dessa classe podem induzir a produção de EROs por meio da regulação positiva de enzimas da família NADPH oxidase, aumentando sua atividade oxidase. Essas oxidases são expressas na mácula densa de ratos e estão envolvidas na vasoconstricção de arteríola aferente, diminuindo o RFG. Outro efeito promovido por essas enzimas é a redução do óxido nítrico disponível da mácula densa, o que prejudica a vasodilatação dependente do endotélio e, consequentemente, impede o reestabelecimento do RFG[37].
Outro mecanismo que pode explicar a redução do RFG é a liberação de endotelinas pelo endotélio vascular renal lesado. Estas substâncias são secretadas no compartimento basolateral do endotélio pelas células mesangiais e tubulares renais e suas ações estão associadas à vasoconstrição das arteríolas aferentes e eferentes, aumentando a PP, a RVR e reduzindo o RFG[38].
Conclusão
Diante das evidências encontradas pode-se afirmar que, embora a onco-A tenha apresentado baixa letalidade em todos os protocolos experimentais realizados e importante atividade hipotensora, ela mostrou evidências de toxicidade pulmonar, renal e cardíaca, atribuídas aos compostos de sua classe química.
Agradecimentos
À CAPES e à Funcap, pelo apoio financeiro concedido para o desenvolvimento desse trabalho, e a todos os pesquisadores envolvidos.
Referências
1. Lima CMP et al. Avaliação da toxicidade aguda do extrato das cascas de Pithecellobium cochliocarpum (Gomez) Macbr. Rev Bras Pl Med. 2014; 16(4): 832-838. [CrossRef].
2. Koeppen BM, Stanton BD. Berne & Levy – Fisiologia. 6ª ed. Elsevier, 2009. 859p. [Link].
3. Kalil Filho R et al. I Diretriz Brasileira de Cardio-Oncologia da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol. 2011; 96(2 s.1): 01-52. [Link].
4. Casarett SL, Doull J. Toxicology: The Basic Science of Poisons. Curtis D. Klassen. 17th ed. Kansas: McGraw-Hill, 2008. 1331p. [Link].
5. Pupo MT, Gallo MBC, Vieira PC. Biologia química: uma estratégia moderna para a pesquisa em produtos naturais. Quím Nova. 2007; 30(6): 1446-1455. [CrossRef].
6. Monks TJ, Hanslik RP, Cohen GM, Ross D, Graham DG. Quinone chemistry and toxicity. Toxicol Appl Pharmacol. 1992; 112: 2-16. [CrossRef] [PubMed].
7. Abraham I, Joshi R, Pardasani P, Pardasani RT. Recent Advances in 1,4-Benzoquinone Chemistry. J Braz Chem Soc. 2011; 22(3): 385-421. ISSN 0103-5053. [CrossRef].
8. Madeo J, Zubair A, Marianne F. A review on the role of quinones in renal disorders. Springerplus. 2013; 2(1): 139. [CrossRef].
9. Asche C. Antitumour quinones. Mini Rev Med Chem. 2005; 5(5): 449-467. [CrossRef].
10. Costa-Lotufo LV et al. Toxicity to sea urchin egg development of the quinone fraction obtained from Auxemma oncocalyx. J Braz Med Biol Res. 2002; 35(8). [CrossRef].
11. Braga R. Plantas do Nordeste: especialmente do Ceará. 5ª ed. Mossoró, RN: Fundação Guimarães Duque: Fundação Vingt-Un Rosado - ESAM, 495p. 2001. [Link].
12. Ferreira MAD et al. Oncocalyxone A inhibits human platelet aggregation by increasing cGMP and by binding to GP Ibα glycoprotein. Brit J Pharmacol. 2003; 154: 1216-1224. [CrossRef].
13. Sivagnanam I, Kalaivanan P, Rajamanickam M. Anti-diabetic activity of oncocalyxone an isolated from prenanthes sarmentosus. Inter J Pharmacy Pharmac Sci. 2013; 5(4). [Link].
14. Ferreira MAD et al. Analgesic and anti-inflammatory activities of a fraction rich in oncocalyxone A isolated from Auxemma oncocalyx. Phytomedicine. 2004; 11: 315-322. [CrossRef].
15. Leyva A, Pesssoa C, Boogaerdt F, Sokaroski R, Lemos TLG, Wetmore LA et al. Oncocalyxones A and C, 1,4- Anthracenediones from Auxemma oncocalyx: comparison with anticancer 1,9- Anthracenediones. Anticancer Res. 2000; 20(2A): 1029-31. PMID: 10810392. [PubMed].
16. Sbardelotto AB. Estudo do mecanismo de citotoxicidade da oncocalixona-a em leucemia promielocítica humana – linhagem HL-60. 103 fs. 2013. Dissertação de Mestrado [Programa de Pós-graduação em Farmacologia] - Universidade Federal do Ceará, UFC, 2013. [Link].
17. Pessoa ODL et al. R. Novel cordiachromes isolated from Auxemma oncocalyx. Nat Prod Lett. 1993; 2: 145. [CrossRef].
18. Pessoa ODL et al. Cordiachromes from Auxemma oncocalyx. Phytochem. 1995; 6: 1777-1786. [CrossRef].
19. Lahlou S et al. Cardiovascular effects of the essential oil of Croton nepetaefolius in rats: role of the autonomic nervous system. Pl Med (Stuttgart). 1999; 65(6): 553-557. [CrossRef].
20. Siqueira RJB. Estudo dos efeitos cardiovasculares do óleo essencial de Croton zehntneri e de seus principais constituintes, anetol e estragol, em ratos normotensos. 53 fs. 2005. Dissertação de Mestrado [Departamento de Fisiologia e Farmacologia do Centro de Ciências Biológicas] - Universidade Federal de Pernambuco, UFPE, Recife. 2005. [Link].
21. Fonteles MC et al. Support of renal kidney function by long-chain fatty acids derived from renal tissue. Am J Physiol. 1983; 244: 235-246. [CrossRef].
22. Monteiro HAS, Fonteles MC. The effect of Bothrops jararaca venom on rat kidney after short-term exposure: preliminary results. Pharmacol Toxicol. 1999; 85: 198-200. [CrossRef].
23. Balhlmann J, Giebisch G, Ochwadt B. Micropuncture study of isolated perfused rat kidney. Am J Physiol. 1967; 212: 77-82. [CrossRef].
24. Nishiitsuji-Uwo GM, Ross BD, Krebs HA. Metabolic activities of isolated perfused kidney. Biochem J. 1967; 103: 852-862. [CrossRef].
25. Ross BD. The isolated perfused rat kidney. Clin Sci Mol Med Suppl. 1978; 55(6): 513-521. [CrossRef] [PubMed].
26.Walser M, Davidson DG, Orloff J. The renal clearence of alkali-stable inulin. J Clin Invest. 1955, v.34, p.1520-1523. [Link]
27.Langman LJ, Kapur BM. Toxicology: Then and now. Clin Biochem. 2006; 39: 498-510. [CrossRef].
28. Deichmann WB, Keplinger ML. Phenol and phenolics compounds. Industrial hygiene and toxicology. Intersc. New York, p.1383-1385, 1963. ISBN: 978-1-4612-9649-2. [CrossRef].
29. Harty J. Prevention and Management of Acute Kidney Injury. The Ulster Med J. 2014; 83(3): 149-157. [PubMed].
30. Kumar V, Abbas AK, Aster JC. Robbins & Cotran Patologia: Bases Patológicas das Doenças. Elsevier, 8ª ed. 2010. ISBN 13: 978-8535234596. 1480p.
31. Simůnek T, Stérba M, Popelová O, Adamcová M, Hrdina R, Gersl V. Anthracycline-induced cardiotoxicity: overview of studies examining the roles of oxidative stress and free cellular iron. Pharmacol Rep. 2009; 61(1): 154-71. ISSN 1734-1140. [Link].
32. Gammella E, Maccarinelli F, Buratti P, Recalcati S, Cairo G. The role of iron in anthracycline cardiotoxicity. Front Pharmacol. 2014; 5: 25. ISSN 1734-1140. [CrossRef]
33. Constanzo LS. 1947. Fisiologia. 5ª ed., Rio de Janeiro: Elsevier. 2014. 520p. ISBN: 9788535275612.
34. Bonventre JV et al. Next-generation biomarkers for detecting kidney toxicity. Nat Biotechnol. 2010; 23(5): 436-440. [CrossRef].
35. Kumar V, Abbas AK, Aster JC. Robbins-Patologia Básica. 9ª ed. Rio de Janeiro: Elsevier Editora LTDA., 2013. ISBN: 978-4377-1781-5. [Link].
36. Nguyen MV et al. Quinone compounds regulate the level of ROS production by the NADPH oxidase Nox4. Biochem Pharmacol. 2013; 85(11): 1644-54. [CrossRef].
37. Liu R et al. Depolarization of the macula densa induces superoxide production via NAD(P)H oxidase. Am J Physiol Renal Physiol. 2007; 292(6): F1867-1872. [CrossRef] [PubMed].
38. Zanatta CA et al. Papel do sistema endotelina na nefropatia diabética. Arq Bras Endocrinol Metab. 2008; 52(4): 581-588. [CrossRef].