Artigo Original
Investigação preliminar da composição micelial e potencial antimicrobiano de fungos endofíticos da erva-de-passarinho amazônica Cladocolea micrantha (Eichler) Kuijt (Loranthaceae)
Preliminary investigation on the mycelial composition and antimicrobial potential of endophytic fungi from the Amazonian mistletoe Cladocolea micrantha (Eichler) Kuijt (Loranthaceae)
Resumo
As espécies de fungos endofíticos Gignardia mangiferae, Paecilomyces clavisporus e Pestalotiopsis guepinii foram isoladas dos tecidos das folhas e caules da planta medicinal Cladocolea micrantha (Loranthaceae), coletada em Manaus, Amazonas. Após replicação, os organismos endofíticos foram fermentados em meio líquido de cultura, e as biomassas miceliais foram filtradas e secas. Após filtração, os sobrenadantes e os extratos metanólicos dos micélios foram testados in vitro contra os microorganismos patogênicos Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli, Enterococcus faecalis, e Mycobacterium tuberculosis, pelos ensaios de microdiluição de Unidade Formadora de Colônia e Alamar Blue. Os três primeiros tiveram o crescimento inibido entre 77 - 88% pelo fermentado de G. mangiferae e P. clavisporus. Outros resultados de inibição indicaram que os extratos dos fungos apresentaram potencial contra os organismos Gram-positivos. O crescimento de E. faecalis foi moderadamente inibido (22 - 42%) pela maioria dos extratos e nenhuma amostra foi eficaz contra M. tubeculosis. As frações solúveis foram evaporadas e submetidas a um fracionamento seqüencial por solventes de polaridade crescente. As análises das frações menos polares pelos métodos cromatográficos rotineiros levaram à caracterização da presença incomum dos álcoois triterpênicos αe β-amirina, assim como das cetonas correspondentes αe β-amirona, juntamente com ácidos graxos saturados e insaturados C16 -C18. Já os esteróis comuns, ergosteróis ou sitosteróis, não foram detectados. A preferência biossintética dos organismos endofíticos pela produção de triterpenos sugere uma estratégia competitiva para se estabelecerem na planta hospedeira.
- Unitermos:
- Cladocolea micrantha.
- Organismos Endofíticos.
- Atividade Antimicrobiana.
- Triterpenos Miceliais..
Abstract
The endophitic fungi species Gignardia mangiferae, Paecilomyces clavisporus and Pestalotiopsis guepinii were isolated from leaf and stem tissues of the medicinal epiphytic plant Cladocolea micrantha (Loranthaceae) collected in Manaus, Amazonas. After maltagar extract culturing, they were fermented separately in liquid culture medium, for 7 to 14 days. The culture broth was filtrated and lyophilized. The mycelia residues were extracted with methanol and dried. The lyophilized filtered broth (LFB) and the methanol-soluble fraction (MSF) were assayed in vitro against the pathogenic organisms Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli, Enterococcus faecalis and Mycobacterium tuberculosis through the Colony-Forming Unity microdilution and Alamar Blue tests. The first three were inhibited in the range of 77 - 88% by two G. mangiferae and one P. clavisporus broth samples. Overall results indicated the potential efficacy of the LFB against Gram-positive organisms. The growth of E. faecalis was moderately inhibited (22 - 42%) by most of the samples tested and not one resulted positive for M. tuberculosis. The MSF was submitted to a polarity-gradient solvent fractioning. Analyses of the less polar fractions by usual chromatography methods led to the uncommon characterization of the triterpene alcohols αand β-amyrin and their corresponding ketones αand β-amyrone, along with saturated and unsaturated C16-C18 fatty acids. The presence of sterols as ergosterols or sitosterols was not detected. The preferential metabolic route to produce the majority of triterpenes by the endophitic organisms suggests a competitive strategy for their establishment in the host plant biota.
- Key Words:
- Cladocolea micrantha.
- Endophytic Organisms.
- Anti-Microbial Activity.
- Mycelial Triterpenes..
Introdução
Os fungos são valiosas fontes de moléculas que apresentam atividades biológicas importantes, como antibacteriana, antifúngica, e diversas outras. O potencial químico dos fungos é demonstrado pela ampla capacidade de produzir uma diversidade enorme de metabólitos bioativos, que está associado a um alto “índice criativo” (DREYFUSS; CHAPELA, 1994). A maioria dos fungos estudados até o presente momento tem sido isolada do solo (SAWAI et al., 1981), como é demonstram os casos do Streptomyces avermitilis e do Tolyplocladium inflatum na produção de arvemectina e da ciclosporin A (BOREL, 1986; DREYFUSS et al., 1976; GILMAN et al., 1985), respectivamente. O agente antifúngico griseofulvina do Penicillium griseofulvum (REHM, 1980) e o inibidor da biossíntese do colesterol lovastatin, de Aspergillus terreus (ALBERTS et al., 1980), são dois exemplos adicionais de importantes metabólitos fúngicos (SOHRAB, 2005).
Nos últimos 30 anos, este potencial para a descoberta de novos produtos terapêuticos e agroquímicos estendeu-se à obtenção de metabólitos a partir de organismos endofíticos (AZEVEDO et al., 2000; SAIKKONEN et al., 2004; ARNOLD et al., 2003; STROBEL et al., 2003; STROBEL et al., 2004a; STROBEL et al., 2004b; KOGEL et al., 2006; FERRARA, 2008). As comunidades de fungos endofíticos ocupam órgãos intercelulares no reino vegetal, usualmente induzindo uma relação associativa que varia do mutualismo ‘útil-para-ambos’ ao parasitismo nocivo para a planta hospedeira (ARNOLD et al., 2003). Esta simbiose pode conferir algumas propriedades úteis para este último, como por exemplo, o aumento de sua proteção contra insetos herbívoros ou outros microorganismos fitopatogênicos, por intermédio da produção de toxinas, antibióticos, enzimas específicas, agentes indutivos do crescimento, e outros (STURTZ et al., 1999; LI et al., 2000).
Os fungos endofíticos representam fontes para prospecções inteligentes (SCHULZ et al., 2002). Substâncias antibióticas, antimicóticas, imunossupressoras e anticâncer foram obtidas a partir de cultura de isolados de fungos endofíticos específicos. Exemplos de substâncias antifúngicas são a cryptocandina A do Cryptosporiopsis quercina, que é ativa contra alguns patógenos humanos importantes (STROBEL et al., 1999), e o acido ambuico, produzido pelo Pestalotiopsis microspora encontrado nas florestas tropicais ao redor do mundo (LI et al., 2001). A pestacina e isopestacina, antimicrobianas e antioxidantes, obtidas do P. microspora isolado da combretácea Terminalia morobensis (STROBEL et al., 2002; HARPER et al., 2003); o fungo endofítico Fusarium subglutinans produzindo os immunosupressivos subglutinol A e B (LEE et al., 1995a), além de várias outras cepas, incluindo os fungos produtores de paclitaxel, também já estão bem descritos (LEE et al., 1995b; YOUNG et al., 1992; KUSARI et al., 2009). As pestacina e isopestacina obtidas de organismos endofíticos têm sido correlacionadas com algumas plantas medicinais usadas tradicionalmente ao redor do mundo (PETRINI et al., 1992; MONAGHAN, 1995; RODRIGUES et al., 2000). O presente estudo descreve a cultura de fungos endofíticos isolados da erva-de-passarinho amazônica Cladocolea micrantha (Loranthaceae) e das folhas e galhos da sua planta hospedeira, Anacardium occidentale (Anacardiaceae). Os caldos de culturas e os extratos alcoólicos miceliais foram submetidos a ensaios preliminares, relacionados à atividade contra cinco microorganismos patogênicos. A investigação preliminar da constituição química dos micélios também foi realizada.
Material e Métodos
Material Botânico e Isolamento dos Fungos Endofíticos
Folhas e galhos de Cladocolea micrantha crescendo em uma árvore de Anacardium occidentale (cajueiro) foram coletadas pelos autores no campus da Universidade do Amazonas (UFAM), Manaus, para a análise da micobiota. Ambas as espécies foram identificadas e um único voucher foi depositado no Herbário da UFAM sob no. 6213. Os fungos endofíticos foram isolados de acordo com o procedimento de Petrini (1992). O material botânico foi cuidadosamente lavado com detergente neutro e água corrente. Após secagem, as folhas e galhos foram fragmentados em pequenas lascas de cerca de 8 mm2 e imersas durante 1 minuto em béqueres de 500 mL contendo 70% etanol em água. Os fragmentos foram então transferidos para outros recipientes contendo uma solução de hipoclorito de sódio 3% por 3 a 4 minutos, dependendo da espessura do tecido vegetal. Em seguida, os fragmentos foram colocados de volta no béquer contendo a solução hidroalcoólica por mais 30 segundos, e finalmente foram transferidos para um frasco com água esterilizada por 1 minuto. Após este procedimento de desinfecção, 4 a 6 fragmentos foram submetidos à 32 placas (Difco) de cultura em extrato de malte-ágar (MAE) contendo cloranfenicol (0.5 g/L MAE), com auxílio de uma alça de Drigalski. O controle negativo constittuiu na aplicação de 0.1 mL da água destilada do último passo da esterilização em placas de Petri, usando o mesmo meio. As amostras de cultura foram submetidas à temperatura ambiente (cerca de 25 oC) e observadas diariamente. Após 11 dias, as colônias foram contadas e as cepas representativas de cada espécie foram transferidas para tubos de ensaio e placas de Petri contendo MAE para a avaliação quantitativa das colônias de fungos. As cepas isoladas foram identificadas pela determinação de macroe micromorfologia. Depois de liofilizadas, foram armazenadas em óleo mineral.
Cultura Fúngica e Preparação dos Extratos
As cepas de Guignardia mangiferae, Paecilomyces clavisporus and Pestalotiopsis guepinii foram inoculadas em placas contendo MAE. Conforme a cultura madura começou a esporular, o meio sólido foi cortado em quadrados de 8 mm2, que então foram distribuídos em seis frascos Erlenmeyer de 1 L, cada um contendo 4-6 pedaços e 300 mL de solução de MAE. Durante a fermentação, estes frascos foram agitados circularmente (150 rpm) 12 horas por dia, a 25 oC e sob luz. O processo fermentativo foi interrompido e metade do volume original (900 mL) foram retirados do meio, enquanto o resto continuou a fermentar por um período adicional. Assim, as amostras foram preparadas após 7 e 11 dias para Guignardia mangiferae, 11 e 14 dias para Paecilomyces clavisporus, e 8 e 14 dias para Pestalotiopsis guepinii. Cada porção retirada do meio de cultura foi filtrada em funil de Büchner (papel de filtro A3, trompa de vácuo), e a suspensão resultante foi re-filtrada em Millipore 0.2 μm estéril. Após liofilização, estas frações foram ensaiadas para a atividade antibacteriana. O material micelial retido para cada amostra foi extraído por maceração em metanol, à temperatura ambiente (3 x 100 mL). A solução metanólica foi filtrada por gravidade e os extratos similares foram combinados, evaporados e liofilizados, para a determinação dos rendimentos e para os ensaios antibacterianos (Figura 1).
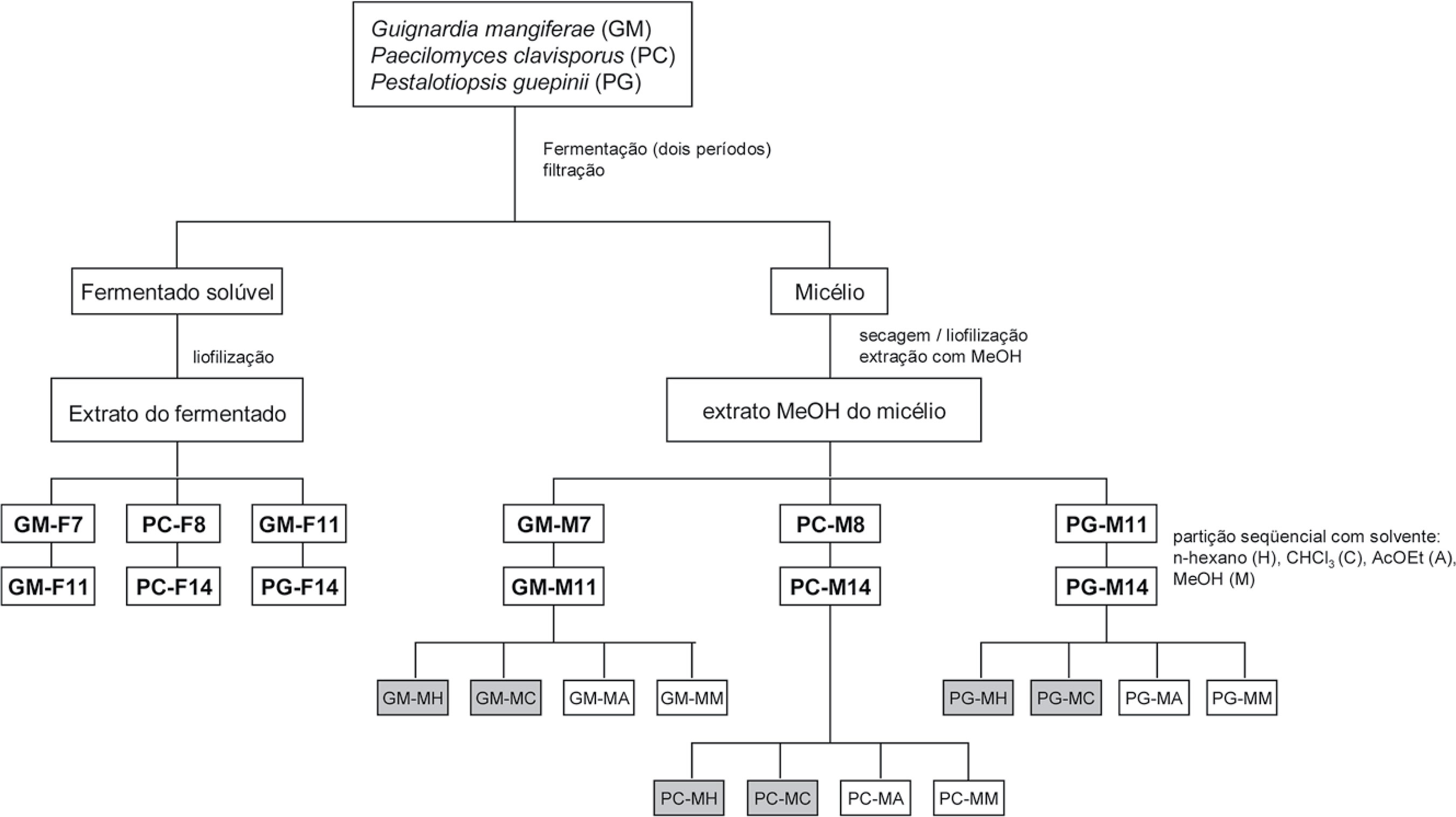
Análise e Caracterização de Triterpenos Miceliais
Os extratos metanólicos brutos dos pellets (0.90 - 1.3g) foram separadamente submetidos a colunas cromatográficas abertas (gel de sílica 60, 10 g, h 20 cm, ф 1.2 cm), eluídos seqüencialmente com porções de 80 mL de n-hexano, clorofórmio, acetato de etila e metanol, respectivamente. Os solventes foram removidos em evaporador rotatório e os rendimentos foram determinados. As frações foram analisadas por CCD (cromatoplacas de gel de sílica 60 PF254 20 cm x 20 cm x 0.25 mm Merck, Darmstadt, GE) eluídas com CHCl3:MeOH 9.5:0.5 ou n-hexano:AcOEt 8:2 for (solventes grua P.A. Vetec, Xerém, Brazil ou Merck, Darmstadt, GE) e reveladas com anisaldeído em metanol-ácido sulfúrico (WAGNER et al., 1983) ou vanilina em etanol-ácido sulfúrico (STAHL, 1969), e CGAR-EM. As análises por cromatografia de gás acoplada à espectroscopia de massas foi realizada num cromatógrafo Hewlett Packard modelo 6890 acoplado a um analisador de massas por impacto de elétrons a 70 eV, equipado com uma coluna capilar HP-5MS (30 m x 0.32 mm i.d. x 0.25 µm de espessura do filme); hélio como gás carreador, fluxo de 1.0 mL/min, temperatura do injetor 250 °C, temperatura do forno programada de 140 °C - 290 ºC a 5 °C/min. Foram injetadas amostras de 1 µL de uma solução de 2-4 mg/mL em CH2Cl2 com razão de split 1/20. A caracterização dos triterpenos foi realizada com base em seus padrões de fragmentação (BUDZIKIEWICZ et al., 1964), e por correspondência dos espectros obtidos com aqueles armazenados na biblioteca eletrônica Wiley 59943B. As identidades de αe β-amirinas foram confirmadas pela co-injeção com amostras certificadas. Os ácidos graxos foram co-injetados com amostras comerciais (Sigma-Aldrich, St. Louis, MO, USA). As presenças dos triterpenos e respectivos tempos de retenções foram corroborados pela análise das frações clorofórmicas (GM-MC, PC-MC, PG-MC; ver Figura 1) pelo modo splitless, mantendo-se o detector desligado por 40 minutos após o início da corrida.
Material Biológico
As cepas de Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 e Enterococcus faecalis ATCC 29212 foram cultivadas pelo método de microdiluição e Unidade Formadora de Colônia (UFC), de acordo com Woods e Washington (1995). Após o crescimento bacteriano em meio de Mueller-Hinton (MH), as suspensões foram preparadas com meio esterilizado de cultura MH, até que a turbidez alcançasse o valor de 0,5 na escala McFarland. Este método antimicrobiano foi padronizado para substâncias puras no Serviço Bacteriológico para Teste de Drogas no Instituto de Pesquisa Evandro Chagas, Fundação Oswaldo Cruz, Rio de Janeiro, Brasil.
Ensaios Antimicrobianos
Unidade Formadora de Colônia (UFC): Uma solução-mãe foi preparada pela dissolução de 2 mg de caldo de cultura e de extratos dos micélios de Guinardia mangiferae (GM) ou Paecilomyces clavisporus (PC) ou Pestalotiopsis guepinii (PG) em 250 µL de dimetilssulfóxido (DMSO) e completando o volume final com 1.00 mL de saline (diluição final do extrato 1:4 em DMSO-salina). Uma alíquota de 25 µL desta solução resultante foi adicionada a 475 µL de suspensão de cada cepa bacteriana (P. aeruginosa, S. aureus, E. coli, E. faecalis) em tubos de microcentrífuga esterilizados. O controle positivo interno para a atividade antimicrobiana foi realizado pela adição de 25 µL de solução de gentamicina em salina em vez da amostra. De acordo com o procedimento padrão para diluição simples, as concentrações finais testadas contra as cepas dos microorganismos foram calculadas como 100 µg/mL e 10 µg/mL for os extratos fúngicos e gentamicina, respectivamente. O crescimento bacteriano foi controlado pela adição aos tubos de 25 μg/mL de salina estéril a 0.25% em DMSO. Todas as análises foram realizadas em triplicatas. Todos os tubos foram incubados por 2 h a 37 ºC. Em seguida, os tubos foram homogeneizados em vórtex, e uma alíquota de 100 µL retirada de cada amostra foi diluída até 10-4 por diuição seriada (2 x 9.90:0.01 mL) em saline. A suspensão final (10 µL) foi espalhada no meio MH sólido com alça de Drigalski, e incubada a 37 ºC durante 24 h. Após este período, as UFCs foram contadas.
Ensaio em Microplaca de Alamar Blue (Microplate Alamar Blue Assay; MABA): O screening primário para a atividade antimicobacteriana foi conduzido com Mycobacterium tuberculosis (ATCC 27294 H37Rv) usando-se 100.0 µg.mL-1 dos extratos fúngicos em meio BACTEC12B, por MABA (COLLINS AND FRANZBLAU et al., 1998). Previamente, 200 µL de água deionizada estéril foi espalhada sobre o perímetro externo da placa de 96 poços (Falcon, 30072; Becton Dickinson, Lincoln Park, USA), visando minimizar as perdas do meio de cultura por evaporação durante a incubação. As placas receberam 100 µL de meio de cultura Middlebrook 7H9 (Difco Laboratories, Detroit, USA), sendo inoculadas com a bactéria, acrescentando-se então 100 µL dos extratos diluídos dos fungos endofíticos (100 µg/mL). As placas foram cobertas e seladas com película de parafilme e então incubadas a 37 °C por 5 dias. Após este período, 25 µL de uma mistura 1:1 de Alamar Blue (AccuMed International, Westlake, USA) e uma solução aquosa 10% de Tween 80 foi adicionada às placas, seguindo-se a incubação por 24 h a 37 °C. A cor azul resultante foi interpretada como indicativo negativo e a cor rosa como indicativo positivo do crescimento bacteriano.
Resultados e Discussão
Extratos das Culturas e Rendimentos
As culturas líquidas foram interrompidas após períodos de 7 a 14 dias, dependendo da espécie de fungo. No caso do P. clavisporus, a primeira retirada foi coincidente com o início do escurecimento na aparência da cultura do fermentado. O procedimento geral de fermentação e extração aplicado às cepas dos fungos está resumido na Figura 1. Os rendimentos obtidos para os fermentados, os micélios isolados e seus extratos metanólicos, assim como as suas frações da partição por solventes, estão na Tabela 1. Períodos longos de fermentação diminuíram os rendimentos dos fermentados em 33%, 20% e 74% para G. mangifera (7 a 11 days), P. clavisporus (8 a 14 days) e P. guepinii (11 a 14 days), respectivamente. Considerando-se a primeira e a segunda interrupção da fermentação, houve um aumento expressivo nos pesos dos pellets dos micélios para o caso de P. guepinii (66%), mas não para G. mangifera (11%); enquanto que uma moderada variação negativa foi observada para P. clavisporus (-14%) (Tabela 1). De maneira geral, o primeiro também produziu a maior biomassa, entre as três espécies, nas condições do ensaio. Por outro lado, os rendimentos dos respectivos extratos metanólicos seguiram a tendência mais significantemente para P. clavisporus (-20%), and P. guepinii (-15%) fermentação. O aumento nos períodos de fermentação conduziu a menores rendimentos das frações não polares (hexano e CHCl3) em todos os experimentos. Esta tendência pode estar relacionada ao decréscimo na taxa de crescimento celular, uma vez que as substâncias não polares estão diretamente relacionadas à manutenção da membrana celular. Entretanto, conclusões mais precisas requerem conhecimentos mais específicos sobre o ciclo celular em cada caso.
| Período de Fermentação | ||||||
| Extração/Fração | GM (7 days) | GM (11 days) | PC (8 days) | PC (14 days) | PG (11 days) | PG (14 days) |
| Fermentado liofilizado (F) | 4.06 g | 2.67 g | 2.31 g | 1.85 g | 7.38 g | 5.45 g |
| Pellets secos dos micélios | 4.10 g | 4.57 g | 4.08 g | 3.50 g | 2.05 g | 3.41 g |
| Extrato MeOH dos pellets (M) | 1.33 g | 1.37 g | 1.09 g | 0.87 g | 0.93 g | 0.79 g |
| Fração hexano do micélio (MH) | 29.20 mg (2.21%) | 13.80 mg (1.01%) | 2.70 mg (0.25%) | 15.1 mg (1.73%) | 3.00 mg (0.32%) | 9.30 mg (1.17%) |
| Fração CHCl3 do micélio (MC) | 30.10 mg (2.28%) | 21.70 mg (1.60%) | 44.0 mg (4.07%) | 23.1 mg (2.64%) | 27.10 mg (2.92%) | 11.30 mg (1.42%) |
| Fração AcOEt do micélio (MA) | 3.50 mg (0.27%) | 10.20 mg (0.75%) | 31.3 mg (2.90%) | 39.9 mg (4.56%) | 30.10 mg (3.24%) | 6.30 mg (0.79%) |
| Fração MeOH do micélio (MM) | 1014 mg (76.7%) | 298.4 mg (21.9%) | 417 mg (38.6%) | 440 mg (50.3%) | 459 mg (49.5%) | 376 mg (47.5%) |
| Para abreviaturas ver esquema da Figura 1. | ||||||
A Tabela 2 resume a constituição dos extratos apolares dos micélios das três cepas fúngicas. A análise preliminar por CG demonstrou a presença de ácidos graxos e triterpenos nos extratos hexânicos e clorofórmicos. Os extratos miceliais das três cepas revelaram as presenças majoritárias de quatro ácidos graxos ordinários, caracterizados como os ácidos saturados palmítico (C16:0) e esteárico (C16:1), e os insaturados oléico (C18:1) e linoléico (C18:2); as espécies insaturadas constituindo os componentes mais abundantes. Algumas variações relativas nos conteúdos destes ácidos foram observadas quando da continuidade da fermentação de cada espécie, principalmente o decréscimo de ácido linoléico e aumento de ácido oléico (uma clara tendência em G. mangiferae). Por outro lado, as espécies saturadas mantiveram seus níveis dentro de um intervalo constante (20-35% para ácido palmítico e 5-10% para esteárico). A mesma tendência entre os ácidos linoléico e oléico em G. mangiferae, também ocorre na medida da massa seca total dos pellets desta espécie (Tabela 1). Para P. clavisporus, observa-se a tendência oposta. Este fato está provavelmente relacionado com a ontogênese específica de cada organismo, uma vez que as substâncias com cadeias insaturadas alcançam sua concentração máxima em células jovens de fungos. A membrana celular deve ser uma estrutura dinâmica, permitindo à célula crescer e responder às variações ambientais. O conteúdo celular deve ser mantido constante, independentemente do ambiente externo, e isto é garantido pela membrana fosfolipídica, que é constituída por ácidos graxos em seu segmento nãopolar. Por este motivo, devido a condicionantes físicos ou volumes celulares variáveis, para permitir que as células mudem sua forma, a proporção adequada entre os ácidos saturados e os insaturados auxilia a manter a membrana fluida, nas temperaturas necessárias para sua sobrevivência. Por outro lado, as gorduras constituem também as principais moléculas responsáveis pelo armazenamento de energia e pelo isolamento do ambiente (BURNETTE, 2009).
| 1Componente | 2Tempo de Retenção | GM (7 dias) | GM (11 dias) | PC (8 dias) | PC (14 dias) | 3PG (11 dias) | PG (14 dias) |
| Ácido palmitico | 15.10 min | 22.35 (H) 14.65 (C) |
22.40 (H) 14.29 (C) |
17.11 (H) NI (C) |
20.32 (H) NI (C) |
25.92 (H) 9.39 (C) |
NI (H) NI (C) |
| Ácido linoléico | 19.63 min | 36.20 (H) 27.24 (C) |
22.09 (H) 13.61 (C) |
4.40 (H) 24.63 (C) |
30.66 (H) NI (C) |
51.88 (H) 39.79 (C) |
NI (H) NI (C) |
| Ácido oléico | 19.75 min | 37.45 (H) 26.74 (C) |
48.84 (H) 56.32 (C) |
22.98 (H) 34.51 (C) |
37.17 (H) NI (C) |
4.31 (H) 2.20 (C) |
NI (H) NI (C) |
| Ácido esteárico | 20.43 min | 3.99 (H) 1.63 (C) |
4.70 (H) NI (C) |
6.20 (H) NI (C) |
3.83 (H) NI (C) |
9.73 (H) NI (C) |
NI (H) NI (C) |
| β-amirina | 48.11 min | 17.61 (C) | 9.19 (C) | - | - | 11.91 (C) | 12.15 (C) |
| βamirona | 47.48 min | - | 13.05 (C) | - | - | - | - |
| α-amirona | 48.42 min | 16.20 (C) | 29.77 (C) | NI (C) | 24.61 (C) | - | 8.80 (C) |
| α-amirina | 49.06 min | 40.99 (C) | 24.49 (C) | NI (C) | 11.74 (C) | 13.61 (C) | 33.24 (C) |
| 1Análise da região dos triterpenos foi executada pela supressão da detecção durante a corrida dos ácidos graxos (see parte experimental). 2Para condições de CG-EM: ver parte experimental. GM = Guinardia mangiferae; PC = Paecilomyces clavisporus; PG = Pestalotiopsis guepinii. NI = Picos não integrados. 3Análise dos espectros de massas referentes a sinais menores do cromatograma indicou as possíveis presenças de outros triterpenos do tipo ursano e oleanano. | |||||||
As presenças dos triterpenos αe β-amyrina e as cetonas respectivas αe β-amyrona, foram caracterizadas em todos os extratos miceliais. As identidades das amirinas e amironas (compatíveis com as formulas moleculares C30H50O e C30H48O, respectivamente) foram confirmadas pelos padrões de fragmentação característicos no espectro de massas, conforme indicado pela biblioteca eletrônica Wiley (Budzikiewicz, 1963), e também pela comparação das amirinas com substâncias de referência em CCD. Traços de alguns outros triterpenos presentes nos extratos miceliais apolares foram sugeridos pelo sinal diagnóstico do íon molecular [M]+, contudo a caracterização inequívoca foi limitada pelo método de detecção. Já os esteróis fúngicos mais comuns não foram detectados nas análises dos micélios, ao nível de detecção do método. CCD comparativos demonstraram a similaridade entre os perfis de triterpenos dos micélios dos fungos e dos extratos da erva-de-passarinho. Por outro lado, não há qualquer correspondência entre os perfis cromatográficos de todos os extratos dos fermentados e do extrato metanólico de Cladocolea michranta. As substâncias esteroidais usualmente perfazem 1% da composição da membrana celular. Normalmente, elas são principalmente (até 95%) representadas pelo ergosterol e outras substâncias estruturalmente relacionadas (GRIFFITHS et al., 2003). Embora muito comum em plantas superiores, os triterpenos são raramente descritos nas membranas celulares de fungos, como é o caso de β-amirina em certaa cepas de Aspergillus nidulans (GEALT, 1983), seco-oleananos em Phomopsis sp. ou triterpenóides indólicos de plantas de mangue (LI et al., 2008; XU et al., 2007). Estas constituem a exceção à regra de que os triterpenóides são confinados aos organismos fotossintéticos e alguns não-fotossintéticos inferiores. (NES and HEFTMANN, 1981).
Atividade Antimicrobiana
Foram observadas inibições (> 70%) do crescimento bacteriano para os extratos brutos dos fermentados (F) sobre P. aeruginosa, S. aureus e E. coli (Tabela 3). Os extratos de 7 dias dos fermentados de G. mangiferae foi mais ativo na inibição de S. aureus (81,5%), contudo E. coli foi mais suscetível ao fermentado de 11 dias (81,2%).P. aeruginosa respondeu similarmente a ambos (76-77%). Os extratos de 14 dias do fermentado de P. clavisporus foi especialmente ativo (87,5%) contra o crescimento de E. coli, assim como o de 11 dias sobre P. guepinii (81,5%). Os extratos metanólicos dos micélios (M) mostraram o maior intervalo de inibição contra a cepa de P. aeruginosa (50 -70%), com um valor singular de 81% alcançado por P. guepinii (11 days). Apenas uma atividade antibacteriana moderada foi observada sobre E. faecalis. Nenhum extrato foi ativo no teste MABA para M. tuberculosis. Em conjunto, estes resultados apontam para o potencial dos extratos dos três fungos endofíticos contra organismos Grampositivos; onde G. mangiferae foi o mais promissor, nas doses ensaiadas no protocolo.
| Extrato: Fermentado (F) e Micélio (M) | Pseudomonas aeruginosa | Staphylococcus aureus | Escherichia coli | Enterococcus faecalis |
| GM-F7 | 77.4 % | 81.5% | 31.2% | 42.0% |
| GM-B11 | 75.5% | 54.0% | 81.2% | 24.0% |
| PC-F8 | 47.7% | NS | NS | 28.0% |
| PC-F14 | 51.0% | 38.5% | 87.5% | NS |
| PG-F11 | NS | NS | 25.0% | NS |
| PG-F14 | NS | NT | NT | NT |
| GM-M7 | 43.4% | 13.0% | 43.8% | 22.0% |
| GM-M11 | 57.7% | NS | 56.2% | 27.0% |
| PC-M8 | 49.1% | NS | 50.0% | 42.0% |
| PC-M14 | 68.0% | 5.1% | 43.8% | 25.0% |
| PG-M11 | 64.3% | NS | 81.5% | 27.0% |
| PG-M14 | 32.1% | NS | 12.5% | 9.3% |
| Para abreviaturas, ver
|
||||
Conclusão
Apesar da diversidade biológica extremamente alta no mundo tropical e da inexaurível fonte de novas possibilidades para a descoberta e aplicações industriais e na agricultura, os estudos sobre fungos endofíticos ainda são prevalentes em substratos encontrados em regiões temperadas (RAVIRAJA, 2005; TEJESVI et al., 2007). O isolamento de P. clavisporus, P. guepinii e do ascomiceto cosmopolita G. mangiferae (BAAYEN et al., 2002) contribuem com a prospecção sobre o potencial medicinal da diversidade de fungos da Amazônia; fato que é enfatizado pelo uso medicinal popular da erva-de-passarinho C. michrantha que cresce sobre o A. occidentale (GUIMARÃES, 2006).
A presença de αe β-amirina e seus derivados oxidados na composição micelial corrobora a interação simbiótica entre o endófito e a erva-de-passarinho, sinalizando vantagens mútuas no habitat em que vivem. Na maior parte dos tecidos vegetais, os triterpenos ocorrem como derivados glicosilados, e suas atividades fisiológicas é baseada na habilidade de interagir com os componentes de sistemas biológicos, primariamente com os esteróis, formando a estrutura das biomembranas. Duas funções importantes podem ser alcançadas por estas interações: (i) a melhoria da permeabilidade seletiva da célula (POPOV et al., 1982), e (ii) o aumento na capacidade de defesa das interações antagonistas de sistemas biológicos, garantindo a imunidade da planta contra as doenças fúngicas (ANISIMOV, 1987). Dentro do objetivo de investigar esta última assertiva, os glicosídeos triterpênicos foram ensaiados com sucesso quanto à atividade antimicrobiana (SHCHEGLOV et al., 1979; ANISIMOV, 1979). No caso dos endófitos, estas vantagens deveriam ser alcançadas pelo fungo a partir da planta hospedeira, pela incorporação dos triterpenos (típico metabólito de planta fotossintética) na estrutura do micélio, demonstrando, desta maneira, a capacidade do fungo em aprender códigos genéticos relacionados à sua sobrevivência e competitividade (eventualmente sintetizando algumas substâncias fitoquímicas originalmente associadas com a planta hospedeira). Por sua vez, dentro de uma visão co-evolucionária, os microorganismos endofíticos aumentam a resistência da planta hospedeira à adversidade, pela secreção de metabólitos secundários bioativos (GE et al., 2008). As medidas de atividade antibacteriana preliminar dos três extratos fúngicos apontaram para tal potencial biológico em G. mangiferae, tanto quanto em P. clavisporus e P. guepinii contra organismos Gram-positivos, especialmente P. aeruginosa, nas doses ensaiadas no presente estudo. G. mangiferae é uma boa candidata a futuros ensaios antimicrobianos.
Agradecimentos
Os autores agradecem à Dra. M. Antonieta Ferrara pelo auxílio no isolamento dos fungos.
Referências
ALBERTS, A.W.; CHEN, J.; KURON,G.; HUNT, V.; HUFF, J.; HOFFMAN, C.; ROTHROCK, J.; LOPEZ, M.; JOSHUA, H.; HARRIS, E.; PATCHETT, A.; MONAGHAN, R.; CURRIE, S.; STAPLEY, E.; SCHONBERG, G.-A.; HENSENS, O.; Hirshfield, J.; Hoogsteen, K.; Liesch, J.; Springer, J. Mevinolin: a highly potent competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterollowering agent. Proceedings of the National Academy of Sciences of the United States of America, v.77, n.7, p.3957-3961, 1980
ANISIMOV, M.M.; SHCHEGLOV, V.V.; STRIGINA, L.I.; CHETYRINA, N.S.; UVAROVA, N.I.; OSHITOK, G.I.; ALAD’INA, N.G.; VECHERKO, L.P.; ZORINA, A.D.; MATYUKHINA, L.G.; SALTYKOVA, I.A. Chemical structure and antifungal activity of a number of triterpenoids. Bulletin of the Academy of Sciences of the USSR, v.6, n.4, p.464-468, 1979.
ANISIMOV, M.M. Triterpene glycosides and the structural-functional properties of membranes. Nauchnye Doklady Vysshei Shkoly. Biologicheskie Nauki, v.10, p.49-63, 1987.
ARNOLD, A.E; MEJÍA, L.C.; KYLLO, D; ROJAS, E.I.; MAYNARD, Z.; ROBBINS, N.; HERRE, E.A. Fungal endofhytes limit pathogen damage in tropical tree. Proceeding of the National Academy of Sciences of States of America, v.100, n.26, p.15649-15654, 2003.
AZEVEDO, J.L.; MACCHERONI, J.R.W.; PEREIRA, J.O.; ARAÚJO DE, W.L. Endophytic Microorganisms: a review on insect control and recent advances on tropical plants. Electronic Journal of Biotechnology, v.3, n.1, p.40-65, 2000.
BAAYEN, R.P.; BONANTS, P.J.M.; VERKLEY, G.; CARROLL, G.C.; VAN DER AA, H.A.; WEERDT, M. DE; VAN BROUWERSHAVEN, I.R.; SCHUTTE, G.C.; MACCHERONI JR.,W.; GLIENKE DE BLANCO,C.; AZEVEDO, J.L. Nonpathogenic Isolates of the Citrus Black Spot Fungus, Guignardia citricarpa, Identified as a Cosmopolitan Endophyte of Wood Plants, G. mangiferae (Phyllosticta capitalensis). Phytopathology, v.92, n.5, p.464-477, 2002.
BOREL, J.-F. Immunological Properties of cyclosporine (Sandimmune) in Advances in Immunopharmacology. Eds.: L. Chedid, J. W. Hadden, F. Spreafico, P. Dukor, D. Willoughby, vol. 3. Pergamon Press, Oxford, 1986.
BUDZIKIEWICZ H.; WILSON J.M.; DJERASSI, C. Mass Spectrometry in structural and stereochemical problems. XXXII. Journal of American Chemical Society, v.85, p.3688-3699, 1963.
BURNETTE, J.M. Department of Biological Sciences, Carnegie Mellon, Mellon College of Science, Pittsburg, PA. The Structure and Function of the Cell Membrane, 2009. (http://telstar.ote.cmu.edu/biology/downloads/membranes/index.html) Accesso em 14/02/2009.
COLLINS, L.A.; FRANZBLAU, S.G. Microplate Alamar Blue Assay versus BACTEC 460 System for High-Throughput Screening of Compounds against Mycobacterium tuberculosis and Mycobacterium avium. Antimicrobial Agents and Chemotherapy, v.41, n.5, p.1004-1009, 1997.
DREYFUSS M.M.; CHAPELA, I.H. Potential of fungi in the discovery of novel, low-molecular weigh pharmaceuticals. In: The Discovery of Natural products with Therapeutic Potential, VP Gullo Ed., Butterworth-Heinemann, Boston, MA, 1994, p. 49-80.
DREYFUSS, M.; HÄRRI, E.; HOFMANN, H.; KOBEL, H.; PACHE, W.; TSCHERTER, H. 1976. Cyclosporin A and C New Metabolites from Trichoderma polysporum (Link ex Pers.) Rifai. Applied Microbiology and Biotechnology, v.3, p.125-133, 1976.
FERRARA, M.A. Fungos Endofíticos. Potencial para a Produção de Substâncias Bioativas. Revista Fitos, v.4, n.1, p.73-79, 2008.
GE, H.M.; SHEN, Y.; ZHU, C.H.; TAN, S.H.; DING, H.; SONG, Y.C.; TAN, R.X. Penicidones A-C, three cytotoxic alkaloidal metabolites of an endophytic Pennicilium sp. Phytochemistry, v.69, p.571-576, 2008.
GEALT, M.A. Isolation of β-amyrin from the fungus Aspergillus nidulans. Journal of General Microbiology, v.129: p.543-546, 1983.
GILMAN, A.G.; GOODMAN, L.S.; RALL, T.W.; MURAD, F. The Pharmacological Basis of Therapeutics Macmillan, New York, 1985. p.1298-1299.
GRIFFTHS, K.M.; BACIC, B.J.; HOWLETT, B.J. Sterol composition of mycelia of the plant pathogenic ascomycete Leptosphaeria maculans. Phytochemistry, v.62, p.147-153, 2003.
GUIMARÃES, A.C. Aspectos etnobotânicos e químicos da família Loranthaceae e Viscaceae: potencialidades terapêuticas das ervas-de-passarinhos parasitas. Revista Fitos, v.2, n.1, p.27-47, 2006.
HARPER, J.K.; ARIF, A.M.; FORD, E.J.; STROBEL, G.A.; PORCO, J.J.A.; TOMER, D.P.; O’NEILL, K.L.; HEIDER, E.M.; GRANT, D.M. Pestacin: a 1,3-dihydro isobenzofuran from Pestalotiopsis microspora possessing antioxidant and antimycotic activities. Tetrahedron, v.59, p.2471-2476,2003.
KOGEL, K.-H.; FRANKEN, P.; HÜCKELHOVEN, R. ENDEOPHYTE OR PARASITE - WHAT DECIDES? Current Opinion in Plant Biology, v.9, p.358-363, 2006.
KUSARI, S.; ZUHLKE, S.; SPITELLER, M. An endophytic fungus from Camptotheca acuminate that produces camptothecin and analogues. Journal of Natural Products, v.72, n.1, p.2-7, 2009.
LEE, J.; LOBKOVSKY, E.; PLIAM, N.B.; STROBEL, G.A.; CLARDY, J. Subglutinols A and B: Immunosuppressive compounds from the endophytic fungus Fusarium subglutinans.The Journal of Organic Chemistry, v.60, n.22, p.7076-7077, 1995.
LEE, J.; YANG, X.; SCHWARTZ, M.; STROBEL, G.A.; CLARDY, J. The relationship between the rarest tree in North America and an endophytic fungus. Chemistry and Biology, v.2, p.721-727, 1995.
LI, J.Y.; HARPER, J.K.; GRANT, D.M.; TOMBE, B.O.; BASHYAL, B.; HESS, W.M.; STROBEL, G.A. Ambuic acid, a highly functionalized cyclohesenone with antifungal activity from Pestalotiopsis spp and Monochaetia sp. Phytochemistry, v.56, p.463-468, 2001.
LI, J., STROBEL, G.A.; HARPER, J.; LOBKOVSKY, E.; CLARDY, J. Cryptocin, a potent tetramic acid antimycotic from the endophytic fungus - Cryptosporiopsis quercina. Organic Letters, v.2, p.767-770, 2000.
LI, L.; SATTLER, I.; DENG, Z.; GROTH, I.; WALTHER, G.; MENZEL, K.-D.; PESCHEL, G.; GRABLEY, S.; LIN, W. A-secooleane-type triterpenes from Phomopsis sp. (strain HKI0458) isolated from the mangrove plant Hibiscus tiliaceus. Phytochemistry, v.69, p.511-517, 2008.
MONAGHAN, R.L.; POLSHOOK, J.D.; PECORI, V.J.; BILLS, G.F.; NALLIN-OMSTEAD, M.; STREICHER, S.I. Discovery of novel secondary metabolites from fungi - it is really a random walk trough a random forest. Canadian Journal of Botany, v.73(S1), p.925-931, 1995.
NES, W.D.; HEFTMANN, E.A. Comparison of triterpenoids with steroids as membrane components. Journal of Natural Products, v.44, p.377-400, 1981.
PETRINI, O.; SIEBER, T.N.; TOTI, L.; VIREL, O. Ecology, metabolite production, and substrate utilization in endophytic fungi. Natural Toxins, v.1, p.185-196, 1992.
POPOV, A.M.; ANISIMOV, M.M.; IVANOV, A.S.; KOREPANOVA, E.A.; ANTONOV, V.F. Characteristics of membrane activity of triterpene glycosides. Antibiotiki, v.27, n.4, p.276-280, 1982.
RAVIRAJA, N.S. Fungal endophytes in five medicinal plant species from Kudremukh Range, Western Ghats of India. Journal of. Basic Microbiology, v.45, p.230-235, 2005.
REHM, H.-J. Industrielle Mikrobiologie, vol. 2, Springer-Verlag, Berlin, 1980.
SAIKKONEN, K.; WÄLI, P.; HELANDER, M.; FAETH, S.H. Evolution of endophyte-plant symbioses. Trends in Plant Science, v.9, n.6, p.275-280, 2004.
SAWAI, K.; OKUNO, T.; TERADA, Y.; HARADA, Y.; SAWAMURA, K., SASAKI, H.; TAKAO, S. Isolation and Properties of Two Antifungal Substances from Fusarium solani. Agricultural and Biological Chemistry, v.45, n.5, p.1223-1228, 1981.
SCHULZ, B.; BOYLE, C.; DRAEGER, S.; RÖMMERT, A.-K.; KROHN, K. Endophytic fungi: a source of novel biologically active secondary metabolites. Mycological Research, v.106, n.9, p.996-1004, 2002.
SHCHEGLOV, V.V.; BARANOVA, S.I.; ANISIMOV, M.M.; ANTONOV, A.S.; AFIIATULLOV, SHSH. Antimicrobial action spectrum of triterpene and steroid glycosides. Antibiotiki, v.24, n.4, p.270-273, 1979.
SOHRAB H.M. Isolation and Structure Elucidation of Secondary Metabolites from Endophytic Fungi and the Plant Prismatomeris tetrandra and Synthesis of (+)-Ochromycinone. Fakultät Naturwissenschaften der Universität Paderborn, Germany, PhD Thesis, 2005. Disponível em: http://deposit.ddb.de/cgibin/dokserv?idn=976583038&dok_var=d1&dok_ext=pdf&filename=976583038.pdf
STAHL E. Thin Layer Chromatography, 2nd Ed. Springer-Verlag, New York, 1969.
STROBEL G.; FORD, E.; WORAPONG, J.; HARPER, J.K.; ARIF, A.M.; GRANT, D.M.; FUNG, P.C.W.; CHAU, R.M.W. Isopestacin, an isobenzofuranone from Pestalotiopsis microspora, possessing antifungal and antioxidant activities. Phytochemistry, v.60, p.179-183, 2002.
STROBEL, G.; DAISY, B. Bioprospecting for Microbial Endophytes and their Natural Products. Microbiology and Molecular Biology Reviews, v.67, p.491-502, 2003.
STROBEL, G.; DAISY B.; CASTILLO, U.; HARPER, J. Natural Products from Endophytic Microorganisms. Journal of Natural Products, v.67, p.257-268, 2004.
STROBEL, G.; DAISY, B.; CASTILLO; U. The Biological Promise of Microbial Endophytes and Their Natural Products. Plant Pathology Journal, v.4, p.161-176, 2005.
STROBEL, G.A.; MILLER, R.V.; MILLER,C.; CONDRON, M.; TEPLOW, D.B.; HESS, W.M. Cryptocandin, a potent antimycotic from the endophytic fungus Cryptosporiopsis cf. quercina. Microbiology, v.145, p.1919-192, 1999.
STURTZ, A.V.; CHRISTIE, B.R.; MATHESON, B.G.; ARSENAULT, W.J.; BUCHANAN, N.A. Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soil-borne plant pathogens. Plant Pathology, v.48, p.360-369, 1999.
TEJESVI, M.V.; NALINI, M.S.; MAHESH, B.; PRAKASH, H.S.; KINI, K.R.; SHETTY, H.S.; SUBBIAH, V. New hopes from Tejesvi endophytic fungal secondary metabolites. Boletín de la Sociedad Química de Mexico, v.1, n.1, p.19-26, 2007.
WAGNER, H.; BLADT, S.; ZGAINSKI, E.M. Drogen analyse. Berlin: Springer Verlag. 1983, p.304.
XU, M.; GESSNER, G.; GROTH, I.; LANGE, C.; CHRISTNER, A.; BRUHN, T.; DENG, Z.; LI, X.; HEINEMANN, S.H.; GRABLEY, S.; BRINGMANN, G.; SATTLER, I.; LIN, W. Shearinines D-K, new indole triterpenoids from an endophytic Penicillium sp. (strain HKI0459) with blocking activity on large-conductance calcium-activated potassium channels. Tetrahedron, v.63, p.435-444, 2007.
YOUNG, D.H.; MICHELOTTI, E.L.; SWINDELL, C.S.; KRAUSS, N.E. Antifungal properties of taxol and various analogues. Experientia, v.48, p.882-885, 1992.