Revisão
Do quinino aos antimaláricos sintéticos: o conhecimento das plantas medicinais como estratégia potencial na terapia da CoVID-19
From quinine to synthetic antimalarials: knowledge of medicinal plants as a potential strategy in CoVID-19 therapy
Resumo
CoVID-19 é uma doença infecciosa causada pelo vírus SARS-CoV-2, que apresenta uma sintomatologia complexa, atingindo vários órgãos e sistemas do organismo humano. Estudos com plantas medicinais indicam as diversas atividades farmacológicas que uma mesma espécie vegetal pode apresentar. Plantas com atividade antimalárica têm sido alvo de estudos para o tratamento da CoVID-19, através de suas ações combatendo diretamente o vírus, como na redução ou eliminação dos sintomas. O objetivo deste estudo foi verificar, na literatura científica, o uso das plantas medicinais com atividade antimalárica como potencial estratégia na terapia da CoVID-19. Foram realizadas pesquisa, sistematização de artigos e revisões da literatura de plantas com atividade antimalárica, antiviral, anti-inflamatória e imunomoduladora publicados nos últimos 20 anos. Listou-se 27 espécies de plantas importantes com atividade antimalárica. Dentre essas, plantas dos gêneros Cinchona e Artemisia destacaram-se por apresentarem atividades antimalárica e antiviral, tendo como principais constituintes majoritários, responsáveis por estas atividades, a quinina e a artemisinina, respectivamente. Foi possível destacar a importância e urgência da pesquisa e do desenvolvimento de medicamentos provenientes da diversidade vegetal, considerando a multiplicidade de ações farmacológicas que as plantas selecionadas apresentam, podendo ser potencialmente aplicáveis na terapia contra a CoVID-19.
- Palavras-chave:
- Plantas medicinais.
- SARS-CoV-2.
- CoVID-19.
- Antiviral.
- Anti-inflamatória.
- Imunomoduladora.
Abstract
CoVID-19 is an infectious disease caused by the SARS-CoV-2 virus, which has complex symptoms, affecting various human organs. Antimalarial plants can also have important pharmacological activities in the treatment of other diseases. Thus, plants with antimalarial activity have been the target of studies for the treatment of CoVID-19. The aim of this study was to verify in the scientific literature the use of medicinal plants with antimalarial activity as a potential strategy therapy in CoVID-19. Therefore, research, systematization of articles and literature reviews of plants with antimalarial, antiviral, anti-inflammatory, and immunomodulatory activity published in the last 20 years were carried out. The 27 important plant species with antimalarial activity were listed. Among these, plants of the genera Cinchona and Artemisia stood out for presenting antimalarial and antiviral activities, with the main major constituents responsible for these activities, quinine and artemisinin, respectively. Based on the findings of this study, it is possible to highlight the importance and urgency of research and development of medicines derived from plant diversity, considering the multiplicity of pharmacological actions that the selected plants present, which could potentially be applicable in therapy against CoVID-19.
- Keywords:
- Medicinal plants.
- SARS-CoV-2.
- CoVID-19.
- Antiviral.
- Anti-inflammatory.
- Immunomodulatory.
Introdução
As doenças parasitárias, provocadas por protozoários ou outros seres parasitários, afetam grande parcela da população mundial, causando grande impacto na saúde, limitando a qualidade de vida e o desenvolvimento de muitos países. Dentre as principais parasitoses destaca-se a Malária, presente em praticamente todas as regiões tropicais e subtropicais do mundo desde a Antiguidade[1,2].
A Malária, causada por protozoários do gênero Plasmodium, é considerada a protozoose de maior impacto no mundo[3]. Os medicamentos antimaláricos usados para o tratamento e prevenção da malária são classificados em um grupo heterogêneo. Eles geralmente são divididos com base na estrutura química ou na origem dos medicamentos. A maioria deles derivam da medicina e das plantas tradicionais[4].
O primeiro fármaco descrito utilizado no tratamento da malária foi a quinina, um alcaloide quinolínico presente em árvores nativas da América do Sul e Central, do gênero Cinchona[1,5]. Após a identificação dos princípios ativos, modificações químicas foram introduzidas para aumentar a atividade e melhorar o índice de seletividade. Somente na década de 1920, pesquisas com o objetivo de sintetizar novos compostos no combate a essa doença tiveram seu primeiro sucesso com a síntese de Quinacrina (9-aminoacrinidina)[6].
Estas substâncias apresentam vários mecanismos de ação, muitas vezes ainda não elucidados[4]. Além disso, devido à complexidade dessas moléculas, efeitos colaterais adicionais têm sido relatados. Por essas razões, os medicamentos antimaláricos têm sido estudados, propostos e, às vezes, usados no tratamento de outras patologias, como câncer, doenças autoimunes, dentre outras[4]. Ocorre também que a incidência concomitante da malária e de doenças de origem viral levaram à consideração do possível uso de medicamentos antimaláricos como novos medicamentos antivirais. Finalmente, a falta de novos medicamentos antivirais e vacinas eficazes contra muitas infecções virais tem fortalecido interesse na, potencial, atividade antiviral de medicamentos antimaláricos[4].
No final de 2019, houve um surto epidêmico da Síndrome Respiratória Aguda Grave ocorrido na China, sendo seu agente etiológico identificado como um novo coronavirus (SARS-CoV-2). Esta doença foi caracterizada pela Organização Mundial da Saúde (OMS) como uma Pandemia, denominada de CoVID-19[7]. Apesar da sua rápida identificação, seus aspectos fisiopatológicos ainda não foram totalmente esclarecidos. A alta transmissibilidade do vírus, a falta de antivirais e vacinas, as populações assintomáticas portadoras e transmissoras do vírus, potencialmente grandes, tornaram o manejo, preventivo e clínico da CoVID-19, extremamente desafiador. Esforços contínuos para entender melhor a patogênese dessa doença, sem dúvida, esclarecerá o melhor meio de lidar com a pandemia[8].
Os medicamentos sintéticos podem apresentar efeitos distintos daqueles que foram inicialmente prospectados, devido à falta de seletividade suficiente da molécula para atingir somente os alvos desejados (efeitos adversos e colaterais). No caso das plantas medicinais, normalmente contêm misturas de diferentes compostos químicos que podem atuar individualmente, de forma aditiva ou em sinergia para melhorar a saúde. Sendo assim, as plantas medicinais, como entidades químicas multifuncionais, apresentam grande potencial no tratamento de condições de saúde complicadas[9].
Dada a complexidade fisiopatológica da doença, a qual pode apresentar sintomatologias distintas, o seu tratamento requer a seleção de mais de um alvo farmacológico. Sem a pretensão de esgotar o tema, o presente estudo visa discutir o papel das espécies vegetais com atividade antimalárica associada a diferentes atividades farmacológicas, tais como: antivirais, anti-inflamatórias e imunomoduladoras, que possam ser relevantes à pesquisa, desenvolvimento e produção de medicamentos aplicáveis a terapêutica da CoVID-19.
Material e Método
A pesquisa foi descritiva e qualitativa, obedecendo a uma revisão não sistemática, que buscou encontrar em plantas antimaláricas outras atividades farmacológicas, como: antiviral, anti-inflamatória e imunomoduladora, a fim de conhecer a sistematização da doença CoVID-19, seu mecanismo sistêmico de desenvolvimento e seus efeitos sintomáticos, visando outras fontes potenciais de tratamento frente à CoVID-19.
Para tanto, recorreu-se à busca de artigos científicos originais e de revisão nas bases de dados eletrônicas como PudMed, SciElo e Cochrane. Tendo em vista assegurar a sensibilidade aos resultados do estudo e permitir sua reprodutibilidade, foram utilizados os seguintes termos: (("antimalarials" [Pharmacological Action] OR "antimalarials" [MeSH Terms] OR "antimalarials" [All Fields] OR "antimalarial" [All Fields]) AND ("plants" [MeSH Terms] OR "plants" [All Fields])) AND Review [ptyp], "Quinino" e "Espécies vegetais Antimaláricas". Cabe ressaltar que, primeiramente foram lidos os resumos e a metodologia desses artigos e, após isso, feita a leitura completa dos textos.
Nesta pesquisa foram adotados os critérios de inclusão: a) período de publicação compreendido nos últimos 20 anos; b) artigos nos idiomas: português e inglês; c) para artigos envolvendo atividade farmacológica das plantas, foram considerados aqueles contendo a inclusão do perfil fitoquímico e/ou depósito de voucher. Os critérios de exclusão foram: a) artigos com mais de 20 anos de publicação; b) artigos de avaliação fitoquímica sem depósito de voucher e/ou perfil fitoquímico; c) artigos que não estavam disponíveis na íntegra.
Por tratar-se de uma revisão não sistemática, não houve inclusão de avaliadores, mas destaca-se que os autores trabalharam de maneira independente, compilando os resultados. No total, mais de 300 artigos foram encontrados, 87 duplicados e 108 foram incluídos nesta pesquisa.
Resultados e Discussão
Principais antimaláricos
Os fármacos antimaláricos são baseados em produtos naturais ou compostos sintéticos produzidos a partir da década de 40. Esses fármacos são específicos para cada etapa do ciclo de vida do Plasmodium [1].
Os principais fármacos antimaláricos são classificados, de acordo com o modo de ação, em dois grandes grupos: o primeiro inclui os alcaloides derivados da cinchona, as aminoquinolinas e as acridinas. Acredita-se que esses fármacos podem interferir no metabolismo da glicose em diferentes pontos e também na habilidade do parasita de digerir a hemoglobina. O segundo inclui as pirimidinas e biguanidas e envolve a interferência na síntese do ácido tetra-hidrofólico, importante cofator no processo de síntese de DNA e de aminoácidos[1].
Em 1639, missionários jesuítas levaram consigo algumas cascas de Cinchona para a Europa, onde elas se tornaram o tratamento principal para as febres. Todavia, foi apenas em 1820 que os químicos franceses Pierre Joseph Pelletier e Joseph Bienaime Caventou identificaram o alcaloide quinina como o ingrediente ativo da casca da Cinchona[1]. No período entre as 2 grandes guerras (1918-1939), os programas de apoio à pesquisa e à síntese de substâncias antimaláricas receberam grande impulso em diversos países. A maioria das drogas desenvolvidas, na ocasião, era composta de base quinolínica, que incluem as 4- aminoquinolinas, as 8-aminoquinolinas e os álcoois quinolínico[6]. O mais eficaz dentre esses fármacos foi a cloroquina, mas infelizmente, o uso profilático levou à resistência em muitos países endêmicos. A mefloquina tem sido utilizada no combate ao Plasmodium falciparum resistente à cloroquina. A amodiaquina e a hidroxicloroquina têm sido duas alternativas para o tratamento da malária causada por cepas de P. falciparum resistentes à cloroquina. Algumas 8-aminoquinolinas são eficazes contra formas teciduais primárias e secundárias do parasita, assim como nos seus estágios sexuados. A pamaquina e a primaquina são dois exemplos. A primeira, sintetizada na Alemanha durante a década de 20, é o mais antigo agente antimalárico do grupo das 8-aminoquinolinas. A primaquina é o mais utilizado dos fármacos desse grupo, sendo geralmente co-administrada com um agente esquizonticida sanguíneo, como a cloroquina, a amodiaquina ou a pirimetamina, este último um antagonista do folato. Um derivado do fenantreno, a halofantrina, é efetivo contra a malária resistente à cloroquina e tem sido avaliado para o uso humano, apresentando distúrbios gastrintestinais como seus principais efeitos colaterais[1].
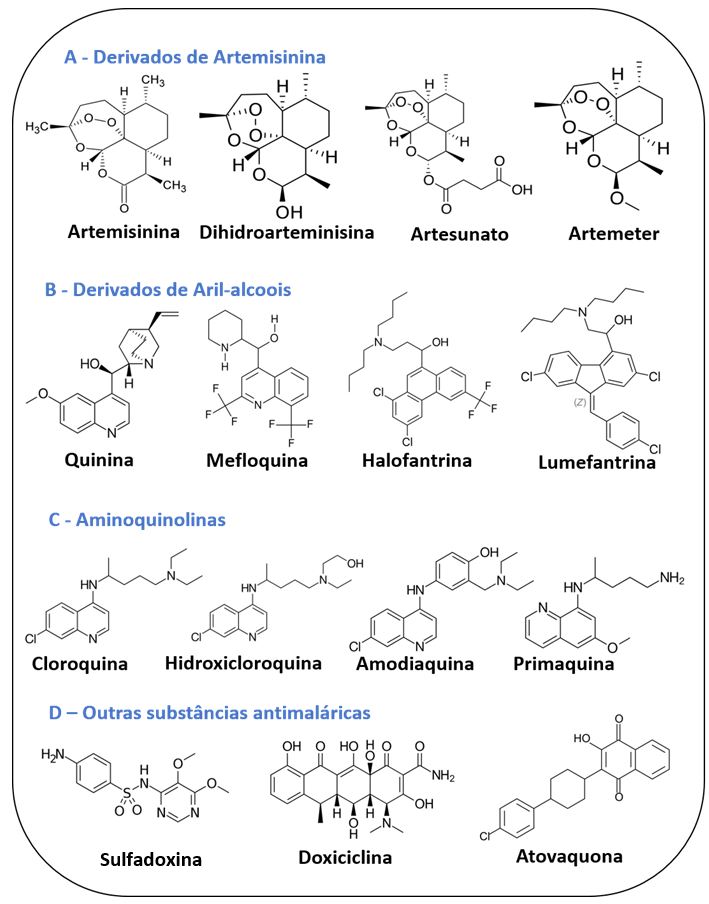
A lumefantrina, também chamado benflumetol, está estruturalmente relacionado com os antimaláricos aril-amino-álcool hidrofóbicos, incluindo mefloquina, quinina e halofantrina, sugerindo que eles têm modos de ação similares. Antagonistas do folato podem atuar como excelentes esquizonticidas no sangue. Dois exemplos desta classe são as sulfonas e as sulfonamidas. A dapsona é a mais conhecida entre as sulfonas antimaláricas. As sulfonamidas antimaláricas incluem a sulfadoxina, a sulfadiazina e o sulfaleno. O segundo grupo de antagonistas do folato liga-se preferencialmente e seletivamente à enzima di-hidrofolato redutase-timidilato sintase (DHFR-TS) do parasita. Membros dessa classe de antifolatos incluem a pirimetamina e a trimetoprima. A combinação da pirimetamina com a sulfadoxina, chamada de Fansidar®, mostrou-se útil como antagonista de outra enzima deste ciclo, a serina hidroximetiltransferase (SHMT). Além disso, a pirimetamina foi combinada com outros fármacos, como a dapsona, o sulfaleno e a cloroquina. A trimetoprima tem um modo de ação similar à pirimetamina, e por ser também um fármaco de ação lenta, tem sido administrada em combinação com fármacos de ação mais rápida, como o sulfaleno. Dentre as biguanidas, destaca-se o proguanil que é um pró-fármaco metabolicamente ciclizado a cicloguanil. Quinonas e naftoquinonas foram utilizadas como antimaláricos durante a Segunda Guerra, com eficiência inferior à cloroquina. Ainda assim, devido à resistência do protozoário frente à cloroquina, compostos desse tipo, como a menoctona, estão sendo reavaliados. A artemisinina, ou qinghaosu, é um produto natural extraído de uma erva medicinal chinesa a Artemisia annua ou Qing Hao como é conhecida pelos chineses. A partir da artemisinina, já foram sintetizados vários análogos com variadas atividades famacocinéticas como o artesunato de sódio, a diidroartemisinina, o arteéter e o arteméter. Estes compostos sesquiterpênicos apresentam uma ponte de peróxido sobre o anel de 7 membros e são esquizonticidas sanguíneos. Estes compostos também possuem atividade gametocida[1].
Além dos fármacos antimaláricos descritos acima, no QUADRO 1 e 2 encontram-se descritos importantes medicamentos antimaláricos que são comercializados mundialmente e no Brasil, apresentados em diferentes combinações[10-15].
A perspectiva de novos medicamentos contra a malária tem sido muito promissora, contudo, ainda estão em estudo clínico[16].
| Classe química | Nome dos Fármacos |
| Combinação de derivados de artemisina e antimaláricos de outras classes | Artemeter-Lumefantrina |
| Artesunato / Sulfadoxina / Pirimetamina | |
| Artesunato / Sulfadoxina / Pirimetamina | |
| Artesunato / Amodiaquina | |
| Artesunato / Pironaridina | |
| Dihidroartemisinina / Piperaquina | |
| Doxiciclina / Artesunato | |
| Outras combinações | Doxiciclina / Quinina |
| Doxiciclina / Mefloquina | |
| Clindomicina / Quinina | |
| Clindamicina / Artesunato | |
| Clindamicina / Mefloquina | |
| Sulfadoxina / Pirimetamina | |
| Cloroquina / Primaquina | |
| Cloroquina /Bulaquina | |
| Dapsona / Clorproguanil | |
| Atovaquona / Proguanil | |
| Adaptado de Pan et al.[13]. | |
| Classe química | Nome dos Fármacos |
| 8-aminoquinolinas | Primaquina |
| 4-aminoquinolinas | Cloroquina |
| Lactona sesquiterpênica + 4-aminoquinolina | Artesunato + Mefloquina |
| Lactona sesquiterpênica + Quinolinometanol | Artemeter + Lumefantrina |
| Adaptado de Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Imunização e Doenças Transmissíveis[15]. | |
Apesar de serem fármacos utilizados no tratamento da malária algum tempo, é sabido que seus efeitos adversos podem se sobrepor aos sintomas da própria doença. Em um estudo realizado no Acre, observou-se que os sintomas apresentados pelos pacientes antes do tratamento com cloroquina e primaquina eram cefaleia, febre, calafrios, sudorese, artralgia, dor nas costas e fraqueza. Após o tratamento com esses fármacos, esses sintomas foram reduzidos, no entanto, houve um aumento da perda de apetite e os sintomas gastrointestinais aumentaram consideravelmente[17].
Outros estudos apontam que apenas as quinolinas têm efeitos cardiovasculares clinicamente significativos. Os medicamentos desta classe podem exacerbar a hipotensão ortostática associada à malária[18-20].
Fisiopatologia da CoVID-19
A enzima conversora de angiotensina humana 2 (ACE2) é um receptor funcional sequestrado pelo SARS-CoV-2 para entrada na célula, semelhante ao SARS-CoV. A ACE2 é uma proteína de membrana tipo I expressa na mucosa nasal, brônquio, pulmão, coração, esôfago, rim, estômago, bexiga, íleo[21,22].
A alta infectividade do vírus está relacionada a mutações no domínio de ligação ao receptor e aquisição de um local de clivagem de furano na proteína S spike. A interação do vírus com ACE2 pode diminuir a função anti-inflamatória e aumentam os efeitos da angiotensina II em pacientes predispostos[8].
A replicação viral primária presume que ocorra no epitélio da mucosa da parte superior do trato respiratório (cavidade nasal e faringe), com posterior multiplicação no trato respiratório inferior e mucosa gastrointestinal, dando origem a uma viremia leve. Poucas infecções são controladas neste estágio inicial ou condição assintomática. Alguns pacientes também exibiram sintomas não respiratórios, como lesão hepática e cardíaca aguda, insuficiência renal, diarreia, implicando envolvimento de múltiplos órgãos[8].
Em casos fatais de infecções humanas por SARS-CoV-2, indivíduos exibem dificuldade respiratória grave, exigindo ventilação mecânica, e os achados histopatológicos também suportam esse diagnóstico. Estudos anteriores descobriram que a suscetibilidade genética e inflamatória das citocinas estava intimamente relacionada à ocorrência de Síndrome do desconforto respiratório agudo (SARDS). Mais de 40 genes candidatos, incluindo ACE2, interleucina 10 (IL-10), fator de necrose tumoral (TNF) e fator de crescimento endotelial vascular (VEGF), entre outros, foram considerados associados ao desenvolvimento de SARDS. Níveis aumentados de IL-6 e IL-8 plasmáticos também demonstraram estar relacionados a efeitos adversos resultados da síndrome. Os biomarcadores acima sugerem uma explicação molecular para a severa SARDS e um possível tratamento após infecção por SARS-CoV-2 [21,22].
Com base nesta descrição concisa, substâncias com possível efeito benéfico na infecção por coronavirus podem atuar em várias etapas: (a) impedindo a ligação do vírus aos receptores ou inibindo a função do próprio receptor, quando ele aciona o processo de internalização, (b) inibindo a replicação viral bloqueando, por exemplo, a RNA polimerase, proteases ou nova montagem de partículas, (c) ajudando a célula a resistir ao ataque viral, ou seja, interrompendo o processo de citotoxicidade, (d) bloqueando a propagação do vírus no corpo, (e) modulando a inflamação quando, partindo de um mecanismo defensivo inato, torna-se ofensiva e citotóxica[23].
Antimaláricos em diferentes alvos farmacológicos frente à CoVID-19
Enquanto a farmacodinâmica é a resposta do corpo ao medicamento, a especificidade de um medicamento é a medida da capacidade de um receptor em responder a um único ligante[24,25]. A baixa especificidade geralmente resulta em possíveis efeitos colaterais. Na verdade, não é incomum para um medicamento ser desenvolvido com uma ação teórica, enquanto um efeito colateral pode surgir como o novo papel alvo[25]. Desta forma, observam-se as diferentes atividades farmacológicas também associadas aos medicamentos antimaláricos. A cloroquina é utilizada no protocolo clínico de doenças autoimunes como artrite reumatoide[26] e lúpus eritematoso[27] e no uso na terapia antitumoral como inibidor da autofagia celular[28]. A primaquina também tem seu uso na terapia de profilaxia de pneumonia em pacientes com Síndrome de Imunodeficiência Adquirida[29,30]. No caso da mefloquina, estudos apontam a sua eficiência no tratamento da Leishmaniose[31]. As substâncias isoladas de plantas com atividade antimalárica também demonstraram efeitos diversos ao preconizado inicialmente, como o quinino na prevenção de câimbras durante a hemodiálise[32] e artemisinina com múltiplas ações farmacológicas, demonstradas in vitro e in vivo, como anticancer, antiparasitoses e anti-inflamatório, dentre outras[33,34].
Desde o início da década de 1970, os pesquisadores se interessaram por outra propriedade dos medicamentos antimaláricos, como a sua atividade antiviral. Assim, foi realizada uma avaliação do efeito dessas substâncias em vírus de várias estruturas e modos de replicação[35].
Em uma revisão minuciosa e atualizada da literatura, Sarah D'Alessandro et al.[3] descreveram os resultados de estudos desenvolvidos in vitro e in vivo de agentes antimaláricos no uso contra infecções virais (FIGURA 1). É importante ressaltar que a maioria destes agentes ou eram de origem natural ou se basearam em estruturas moleculares de substâncias extraídas de plantas.
Embora diversos medicamentos antimaláricos tenham apresentado de alguma forma uma atividade antiviral[4,35], o foco de estudo e aplicação contra o SARS-CoV-2 foram inicialmente a cloroquina e hidroxicloroquina[36].
A cloroquina (CQ), um antigo medicamento antimalárico, e seu derivado hidroxicloroquina (HCQ) tornaram-se cada vez mais populares na tentativa de encontrar um tratamento eficaz para CoVID-19. Estudos in vitro também demonstraram propriedades antivirais potentes de CQ e HCQ. O uso desses medicamentos, no entanto, pode estar associado a efeitos colaterais graves. Nos últimos meses, vários estudos prospectivos revelaram resultados contraditórios em relação à utilidade de CQ e HCQ. A recomendação destes como medicamentos preventivos para pessoas infectadas saudáveis e assintomáticas aguarda um ensaio clínico duplo cego adequado[36,37].
A visão da OPAS e OMS em relação ao uso de cloroquina e hidroxicloroquina para tratamento e profilaxia contra CoVID-19 é que todo país é soberano para decidir sobre seus protocolos clínicos de uso de medicamentos. Embora a hidroxicloroquina e a cloroquina sejam produtos licenciados para o tratamento da malária e de outras doenças, não há evidência científica até o momento de que esses medicamentos sejam eficazes e seguros no tratamento da CoVID-19[38].
Mais recentemente destacaram-se a artemisinina e seus derivados no tratamento de CoVID-19, como descrito por Cheong et al.[34]. A ação antimalárica dos derivados da artemisinina é diferente da cloroquina e hidroxicloroquina, mas seus efeitos imunomoduladores contra distúrbios inflamatórios e replicações virais assemelham-se [34].
A artemisinina pode diminuir a secreção de citocinas pró-inflamatórias derivadas de macrófagos, particularmente de fator de necrose tumoral. Em geral, parece que artemisininas podem assumir um potencial terapêutico imunossupressor em reações imunitárias inflamatórias persistentes em macrófagos por causa da sua capacidade em inibir a liberação de citocinas pró-inflamatórias[34].
Estudos in vitro demonstraram propriedades antivirais onde a artemisinina inibiu a replicação de citomegalovírus humanos (hCMV) através de uma redução na atividade de ligação ao ADN de NF-κB e Sp1. Muitos desses processos fisiopatológicos estão também está presente em doenças respiratórias. Assim, a artemisinina e seus derivados poderiam ser potencialmente utilizados para o tratamento de doenças respiratórias[34].
O extrato de A. annua exibe atividade antioxidante significativa, que é mais provavelmente devido ao seu alto conteúdo fenólico. Derivados de A. annua, como o artesunato, demonstram ser um novo medicamento promissor para tratar a fibrose pulmonar por meio da inibição de moléculas pró-fibróticas[39].
Uma terapia de combinação à base de artemisinina (ACT) em concentrações sanguíneas esperadas após o uso clínico em doses recomendadas em malária, mostrou inibição in vitro da replicação do SARS-CoV-2. A combinação mefloquina-artesunato em uma dose de 550 mg / 250 mg levou a 72,1% de inibição do vírus. Embora a atividade in vitro não esteja necessariamente ligada à eficácia clínica, o acesso à atividade in vitro de ACT contra SARS-CoV-2 pode fornecer algumas respostas se o uso de antimaláricos pode ser indicado no combate à disseminação da pandemia da CoVID-19[40].
Neste sentido, já foram iniciados estudos clínicos para a avaliação da eficácia do artesunato contra a CoVID-19. Com base na página eletrônica Clinical Trials do National Institutes of Health (NIH), existem 4 estudos clínicos em fase inicial de andamento empregando o artesunato no tratamento da CoVID-19[41-44].
A Organização Mundial da Saúde (OMS) acolhe favoravelmente as inovações realizadas em todo o mundo, incluindo no que diz respeito à adaptação de medicamentos, ao uso de medicina tradicional e ao desenvolvimento de novas terapêuticas na busca de potenciais tratamentos contra a doença por SARS-CoV-2. Neste sentido, a OMS reconhece que as medicinas tradicional, complementar e alternativa oferecem vários benefícios. Há uma longa história que mostra o papel importante da medicina tradicional, na prestação de cuidados a saúde da população. Neste contexto, as plantas medicinais, como a Artemisia annua, são indicadas como possíveis agentes terapêuticos para tratamento da CoVID-19 e merecem, por isso, uma avaliação clínica mais extensa para determinar a sua eficácia e os seus efeitos adversos[45].
Plantas medicinais e associação de atividades farmacológicas com potencial terapêutico na CoVID-19
Desenvolvimentos recentes em sistemas biológicos e a experiência clínica em geral revelaram que as drogas de alvo único podem nem sempre induzir o efeito desejado a todo o sistema biológico, mesmo que eles inibam ou ativam com sucesso um alvo específico. Uma razão para tal fato, é que o organismo humano pode afetar a eficácia por meio de formas compensatórias. O desenvolvimento de doenças, particularmente aquelas complexas, envolve vários aspectos. Assim, os cientistas têm proposto recentemente o conceito de design de medicamentos multialvo[46].
Considerando a fisiopatologia da CoVID-19 descrita em item anterior, os principais alvos farmacológicos a serem tratados seriam aqueles que envolvem os processos inflamatórios e imunológicos, além da ação contra o próprio vírus. Neste contexto, no presente trabalho, foi elaborado o QUADRO 3 apresentando algumas espécies importantes com atividade antimalárica descritas na literatura que também possuem ação antiviral e/ou anti-inflamatória e/ou imunomoduladora.
| Nome científico | Família | Parte da planta | Atividades farmacológicas | Tipo de vírus inibido |
| Cinchona L. (Cinchona pubescens; Cinchona calisaya; Cinchona officinalis; Cinchona succirubra) | Rubiaceae | - Cascas da árvore de Chinchona - Substância Sulfato de Quinina |
Antimalárica / Anti-inflamatória / Antiviral[4,35,47,48] | Herpes Vírus Tipo I, Vírus da Dengue, Chikungunya vírus, Vírus da Imunodeficiência Humana (HIV) |
| Artemisia annua; Artemisia opiacea | Asteraceae | - Substância artesunato e artemisinina - Toda planta |
Antimalárica / Antiviral, Imunomoduladora e Anti-inflamatória[4,10, 34, 47, 49] | Citomegalovírus, vírus da hepatite B (HBV), vírus da hepatite C (HCV), papiloma vírus humano (HPV), Vírus da imunodeficiência humana (HIV) |
| Cryptolepis sanguinolenta | Apocynaceae | - Raízes | Antimalárica / Anti-inflamatória / Antiviral[10,11] | HSV-1 |
| Argemone mexicana | Papaveraceae | - Compostos isolados, extratos e frações da espécie | Antimalárica / Antiviral / Anti-inflamatória[50,51] | Vírus da imunodeficiência Humana (HIV) |
| Gymnanthemum amygdalinum (Vernonia amygdalina) | Asteraceae | - Extrato de folhas da espécie | Antimalárica / Imunomodulatória/ Anti-inflamatória[52-54] | Não avaliado |
| Citrus aurantifolia | Rutaceae | - Decocção e infusão de folhas - Decocção da flor - Suco da fruta -óleo |
Antimalárica / Imunomoduladora/ Anti-inflamatória[55,56] | Não avaliado |
| Nauclea pobeguinii | Rubiaceae | extrato das cascas do caule | Antimalárica / Anti-inflamatória[57-59] | HSV-2 |
| Nyctanthes arbor-tristis | Oleaceae | Folhas, sementes | Antimalárica / Imunomoduladora[60-62] | Virus da Encefalomiocardite |
| Quassia amara | Simaroubaceae | Folhas, cascas e raízes | Antimalárica / Antiviral / Anti-inflamatória[52,63,64] | Herpes simplex, Coxsackie Vírus e Vírus da Estomatite Vesicular |
| Physalis angulata | Solanaceae | Substâncias isoladas (fisalinas) de extratos de toda planta, partes aéreas | Antimalárica / Imunomodulatória / Anti-inflamatória / Antiviral [65-67] | Poliovirus-I, Herpes simplex virus-I, Measles virus e HIV-I |
| Piper spp. | Piperaceae | Folha | Antimalárica / Anti-inflamatória/Antiviral [52,68,69] | BHV-1 e Poliovirus (Piper regnelli) |
| Calophyllum spp. | Calophyllaceae | Substância isolada de extratos orgânicos da casca do caule | Antimalárica / Anti-inflamatória / Antiviral [70] | Vírus da Imunodeficiência Humana (HIV), HCoV |
| Psidium guajava | Myrtacaceae | Folha | Antimalárica/Anti-inflamatória/Antiviral [71,72] | Influenza Vírus Tipo A |
| Struchium sparganophora | Asteraceae | Folha | Antimalárica, Anti-inflamatória [73-75] | Não avaliado |
| Ageratum conyzoides | Asteraceae | Folha, planta inteira e partes aéreas | Antimalárica/Anti-inflamatória/Antiviral [74,76,77] | Enteroviruses |
| Ximenia americana | Olacaceae | Caule, casca, folha | Antimalárica / Anti-inflamatória/Antiviral [78-80] | HIV-1 e HIV-2 |
| Tithonia diversifolia | Asteraceae | Folhas e troncos | Antimalárica /Anti-inflamatória /Antiviral [74,81,82] | Herpes simplex vírus do tipo 1 (HSV-1) e Herpes simplex vírus do tipo 2 (HSV-2) |
| Cedrela odorata | Meliaceae | Casca do caule | Antimalárica/Anti-inflamatória [74,83,84] | Não avaliado |
| Morinda lucida | Rubiaceae | Folhas, caule e raíz | Antimalárica / Anti-inflamatória [85,86] | Não avaliado |
| Canna indica | Cannaceae | Folhas | Antimalárica/ Anti-inflamatória / Imunomodulatória/ Antiviral [74,87-90] | HIV-1 |
| Bidens pilosa | Asteraceae | Folhas, flores, caule e sementes | Antimalárica/ Antiviral [91-94] | Herpes simplex vírus |
| Ampelozizyphus amazonicus | Rhamnaceae | Cascas, raíz e folhas | Antimalárica/Anti-inflamatória; Imunomodulatória/ Antiviral [95-97] | HSV1 |
| Xylopia vielana | Annonaceae | Folhas, cascas e frutos | Antimalárica / Anti-inflamatória [98] | Não avaliado |
Dentre as 27 espécies vegetais com atividade antimalárica, indicadas no QUADRO 3, 21 apresentaram resultados com alguma atividade antiviral e também atividade anti-inflamatória e/ou imunomoduladora.
Com base nos dados acima, estas plantas podem indicar uma possibilidade promissora para a terapêutica da CoVID-19, seja individualmente ou em conjunto com outras plantas ou medicamentos.
Tal proposta pode ser corroborada pelos resultados que serão obtidos dos recentes estudos clínicos envolvendo 3 das plantas listadas no Quadro 3.
A ação da Cinchona officinalis contra SARS-CoV-2 tem sido avaliada em um estudo clínico no qual se compara a atividade antiviral entre as combinações C. officinalis / Azitromicina e Hidroclorotiazida / Azitromicina [99].
No gênero Artemisia encontra-se o estudo clínico que irá avaliar a efetividade da combinação mesilato de camostato (inibidor da proteaseTMPRSS2) e Artemisia annua no tratatamento da CoVID-19. Este estudo está em fase inicial (recrutamento) e será realizado com 360 indivíduos [100].
Estudo clínico a ser realizado no Congo empregará a planta Gymnanthemum amygdalinum na avaliação de sua atividade no combate à CoVID-19[101].
A técnica chamada "in silico" é atualmente aplicada para prever comportamento de substâncias no organismo humano e acelerar a velocidade de prospecção de potenciais medicamentos, pois permite o seu rastreamento, reduzindo a necessidade de trabalho de laboratório caro e testes clínicos limitados aos melhores candidatos[23]. Com este objetivo, inúmeros metabólitos secundários de plantas medicinais foram submetidos a estudos de modelagem molecular para avaliar a potencialidade de atividade destas substâncias contra o SARS-CoV-2. Dentre estas plantas, colchicina da Cinchona[102,103], alcaloides de Cryptolepis sanguinolenta[104,105], alcaloides da Argemone mexicana[11], alcamidas e piperamidas diméricas de espécies de Piper[106] e o ácido asiático da Psidium guajava[107].
É evidente que as espécies indicadas acima no Quadro 3 merecem estudos clínicos para avaliar a sua efetividade contra a doença. Embora o custo e o tempo relacionados ao desenvolvimento de novos fármacos e a comprovação de sua eficácia clínica sejam significativos, entende-se que deve ser questionado o paradigma de que somente fármacos sintéticos per se apresentam efetividade e segurança no tratamento de doenças. Para tanto, o conhecimento etnobotânico e científico das plantas medicinais e seus múltiplos usos devem ser consolidados e difundidos de forma sistemática e consistente. Conforme apontam os estudos clínicos apresentados anteriormente, o uso de fármacos sintéticos em associação com plantas medicinais pode propiciar uma forma terapêutica eficaz contra o SARS-CoV-2 ou sintomas promovidos pelo vírus, como é caso das atividades anti-inflamatória e imunomoduladora que estas plantas podem apresentar.
Conclusão
As plantas com atividade antimalárica têm sido estudadas e empregadas em diferentes patologias. Aplicações incluem, por exemplo: dores, infecções bacterianas, infecções fúngicas, febres, diabetes, leishmaniose, dentre outras.
Recentemente, em vista do surgimento da CoVID-19, substâncias de origem vegetal e sintética com atividade antimalárica têm sido empregadas, ainda de forma experimental e empírica, na terapêutica desta doença.
Embora a cloroquina e a hidroxicloroquina sejam exemplos de derivados sintéticos modelados na quinina e testados contra o SARS-CoV-2, com atividade in vitro e in vivo, estes fármacos não apresentaram efetividade terapêutica comprovada nos estudos clínicos realizados.
Por outro lado, 3 espécies de plantas medicinais com atividade antimalárica listadas no presente trabalho são alvos de estudos clínicos para o tratamento da CoVID-19: Cinchona officinalis, Artemisia annua e Vernonia amygdalina. O artesunato, derivado semi-sintético da artemisinina, também é foco de atenção para possível ação contra essa doença, através de estudos in vitro e clínicos.
O desenvolvimento de medicamentos a partir de substâncias naturais, que muitas vezes possuem a vantagem de atingir simultaneamente diferentes alvos moleculares, possibilita vislumbrar um acesso mais facilitado ao tratamento de toda a população através da diminuição nos custos e da independência de importação de insumos para a indústria farmacêutica.
Além disso, o reaproveitamento (repurposing) de medicamentos, representado como uma estratégia eficaz de descoberta de medicamentos a partir de medicamentos existentes, poderia encurtar significativamente o tempo e reduzir o custo em comparação com a descoberta de novos medicamentos e estudos clínicos randomizados[80,108].
Conforme a pandemia se espalha, cientistas de todo o mundo estão explorando ativamente medicamentos para combater um desafio contínuo. É importante desenvolver medicamentos eficazes e seguros para o tratamento da CoVID-19 e o uso de plantas medicinais, como fonte de fármacos através de seus extratos, substâncias isoladas ou derivados sintéticos podem ter um papel fundamental em terapias contra doenças como a CoVID-19.
Agradecimentos
Ao grupo de trabalho COVID-19 do Centro de Inovação em Biodiversidade e Saúde - CIBS/Farmanguinhos, especialmente ao Dr. Benjamin Gilbert pelas valiosas contribuições.
Referências
1. França TCC, Santos MG, Figueroa-Villar JD. Malária: Aspectos históricos e quimioterapia. Quim Nova. 2008; 31(5): 1271-1278. ISSN 1678-7064. [Link].
2. Foye WO, Lemke TL, Williams DA. Principles of Medicinal Chemistry, 4th ed., Williams & Wilkins: Philadelphia.1995; 995p. ISBN-13: 978-0683033236.
3. Gomes AP, Vitorino RR, Costa AP, Mendonça EG, Oliveira MGA, Siqueira-Batista R. Malária grave por Plasmodium falciparum. Rev Bras Ter Intensiva. 2011; 23(3): 358-369. ISSN 0103-507X. [CrossRef].
4. D'Alessandro S, Scaccabarozzi D, Signorini L, Perego F, Ilboudo DP, Ferrante P et al. The Use of Antimalarial Drugs against Viral Infection. Microorganisms. 2020; 8 (1): 85. ISSN 2076-2607. [CrossRef] [PubMed].
5. Bolzani MS, Bolzani VS. Do Peru à Java: A trajetória da quinina ao longo dos séculos. Disponível em: [Link]. Acesso em: 30 mai. 2020.
6. Sá IM. A resistência à cloroquina e a busca de antimalariais entre as décadas de 1960 e 1980. Hist Ciên Saúde Mang. Rio de Janeiro. 2011; 18 (2): 407-430. ISSN 0104-5970. [CrossRef]. Acesso em: 02 dez. 2020.
7. World Health Organization, WHO Publications. Coronavirus disease 2019 (CoVID-19) Situation Report – 51. Geneva, March/2020. Disponível em: [Link]. Acesso em: 13 jun. 2020.
8. Cao W, Li T. CoVID-19: towards understanding of pathogenesis. Cell Res. 2020; 30(5): 367-369. ISSN 1748-7838. [CrossRef] [PubMed].
9. Gurib-Fakim A. Medicinal plants: Traditions of yesterday and drugs of tomorrow. Molec Asp Med. 2006; 27(1): 1-93. [CrossRef] [PubMed].
10. Pan WH, Xu XY, Shi N, Tsang SW, Zhang HJ. Antimalarial activity of plant metabolites. Int J Mol Sci. 2018; 19(5): 1382. ISSN 1422-0067. [CrossRef] [PubMed].
11. Silva O, Barbosa S, Diniz A, Valdeira ML, Gomes E. Plant extracts antiviral activity against herpes simplex virus type 1 and African swine fever virus. Inter J Pharmacog. 1997; 35(1): 12–16. [CrossRef].
12. Kerb R, Fux R, Mörike K, Kremsner PG, Gil JP, Gleiter CH et al. Pharmacogenetics of antimalarial drugs: effect on metabolism and transport [Internet]. Lancet Infect Dis. 2009; 9(12): 760-74. [CrossRef] [PubMed]. [cited 2020 Oct 29].
13. Elewa H, Wilby KJ. A Review of Pharmacogenetics of Antimalarials and Associated Clinical Implications [Internet]. Vol. 42, Europ J Drug Metabol Pharmacok. Springer-Verlag France. 2017; 42(5): 745-56. [CrossRef] [PubMed]. [cited 2020 Oct 29].
14. World Health Organization, WHO Publications. Combination therapies and formulation of antimalarial drug policy. Genova. Jul. 2003. [Link].
15. Brasil. Ministério da Saúde. Guia de tratamento da malária no Brasil [recurso eletrônico] / Secretaria de Vigilância em Saúde, Departamento de Imunização e Doenças Transmissíveis. – Brasília: Ministério da Saúde, 2020. 76 p.: il. Acesso: World Wide Web: ISBN 978-85-334-2754-9. [Link].
16. Koita OA et al. AQ-13, an investigational antimalarial, versus artemether plus lumefantrine for the treatment of uncomplicated Plasmodium falciparum malaria: a randomised, phase 2, non-inferiority clinical trial. Lancet Infect Dis. 2017; 17(12): 1266-1275. ISSN 1473-3099. [CrossRef] [PubMed].
17. Alven S. Aderibigbe Combination therapy strategies for the treatment of malaria Molecules. 2019; 24(19): 3601. [CrossRef] [PubMed].
18. Haeusler IL, Chan XHS, Guérin PJ, White NJ. The arrhythmogenic cardiotoxicity of the quinoline and structurally related antimalarial drugs: A systematic review. BMC Med [Internet]. 2018; 16(1). [CrossRef]. [cited 2020 Nov 4].
19. Al-Bari AA. Chloroquine analogues in drug discovery: New directions of uses, mechanisms of actions and toxic manifestations from malaria to multifarious diseases. J Antimicrob Chemother [Internet]. Nov 12 2014; 70(6): 1608-21. [CrossRef] [PubMed]. [cited 2020 Nov 4].
20. Braga CBE, Martins AC, Cayotopa ADE, Klein WW, Schlosser AR, Da Silva AF et al. Side effects of chloroquine and primaquine and symptom reduction in malaria endemic area (Mâncio lima, Acre, Brazil). Interdiscip Perspect Infect Dis [Internet]. 2015; ID 346853. [CrossRef]. [cited 2020 Nov 4].
21. Jin Y, Yang H, Ji W, Wu W, Chen S, Zhang W et al. Virology, Epidemiology, Pathogenesis, and Control of CoVID-19. Viruses. 2020; 12(14): 372. [CrossRef].
22. Yuki K, Fujiogi M, Koutsogiannaki S. CoVID-19 pathophysiology: A review. Clin Immunol. 215(2020): 108427. [CrossRef].
23. Bellavite P, Donzelli A. Hesperdin and SARS-CoV-2: New Light on the Healthy Function of Citrus Fruits. Antioxidants. 2020; 9(8): 742. [CrossRef].
24. Campbell JE, Cohall D. Pharmacognosy Fundamentals, Applications and Strategies. Academic Press; 1ª ed. 2017. p.513-525. 738p. ISBN-13:978-0128021040.
25. Geoffrey M Currie. Pharmacology Part 1: Introduction to pharmacology and pharmacodynamics. J of Nuclear Med Technol. first published online March 29, 2018. [Link] [CrossRef].
26. da Mota LMH et al. Diretrizes para o tratamento da artrite reumatóide. Rev Bras Reumatol. 2013; 53(2): 158-183. ISSN 0482-5004. [CrossRef].
27. Brasil, Ministério da Saúde, Portaria Nº 100, de 7 de fevereiro de 2013, Aprova o Protocolo Clínico e Diretrizes Terapêuticas do Lúpus Eritematoso Sistêmico [Link].
28. Kimura T, Takabatake Y, Takahashi A, Isaka Y. Chloroquine in Cancer Therapy: A Double-Edged Sword of Autophagy. Cancer Res. 2013; 73(1): 3-7. [CrossRef].
29. Kay R, DuBois RE. Clindamycin/primaquine therapy and secondary prophylaxis against Pneumocystis carinii pneumonia in patients with AIDS. South Medl J. 1990. 83(4): 403-404. [CrossRef].
30 Barber BA, Pegram PS, High KP. Clindamycin/Primaquine as Prophylaxis for Pneumocystis carinii Pneumonia. Clin Infect Dis. 1996; 23(4): 718-722. [CrossRef] [PubMed].
31. de Negreiros PIR, Siqueira TDA. Ações da assistência de enfermagem ao portador de insuficiência renal crônica em tratamento hemodialítico. Bol Info Unimotrisaúde Socioger. 2016; 7(3): 58-70. [Link].
32. Pinheiro MCN, Xavier MB, Cardoso BS, Ferreira MMR, Ishikawa EAI, Silveira FT. Ensaio clínico aberto comparando a mefloquina e o antimoniato de meglumina no tratamento da leishmaniose tegumentar americana na Amazônia. Rev Para Med. 2002; 16(1): 19-24. [Link ].
33. Wang Y, Wang Y, You F, Xue J. Novel use for old drugs: The emerging role of artemisinin and its derivatives in fibrosis. Pharmacol Res. 2020; 157: 104829. [CrossRef].
34. Cheong DHJ, Tan DWS, Wong FWS, Tran T. Anti-malarial drug, artemisinin and its derivatives for the treatment of respiratory diseases. Pharmacol Res. 2020; 158: 104901. [CrossRef].
35. Wolf R, Baroni A, Greco R, Corrado F, Ruocco E, Tufano MA et al. Quinine sulfate and HSV replication: Implications in malaria-endemic areas. Dermato Online J. 2003; 9(3): ISSN 1087-2108. [Link].
36. Li X, Wang Y, Agostinis P et al. Is hydroxychloroquine beneficial for CoVID-19 patients? Cell Death Dis 11. 2020; 512. [CrossRef].
37. Ben-Zvi I, Kivity S, Langevitz P, Shoenfeld Y. Hydroxychloroquine: from malaria to autoimmunity. Clinic Rev Allerg Immunol. 2012; 42(2): 145-153. [CrossRef] [PubMed].
38. Folha informativa CoVID-19 - Escritório da OPAS e da OMS no Brasil. Atualizada em 29 de outubro de 2020. [Link]. Acesso em: 30 out. 2020.
39. Haq FU et al. Artemisia annua: trials are needed for CoVID-19. Phyto Res. 2020; 34(10): 1-2. [CrossRef] [PubMed].
40. Gendrot M et al. Antimalarial artemisinin-based combination therapies (ACT) and CoVID-19 in Africa: in vitro inhibition of SARS-CoV-2 replication by mefloquine-artesunate. Inter J Infect Dis. 2020; 99: [CrossRef] [PubMed].
41. Evaluating the efficacy of artesunate in adults with mild symptoms of CoVID-19, U.S. Nat Libr Med. [Link].
42. Add on to Azythromycine, Phytomedicine and/or Antimalarial Drug vs Hydroxychloroquine in Uncomplicated CoVID-19 Patients (CANCoVID-19). U.S. Nat Libr Med. [Link].
43. CoVID-19 Treatment in South Africa. U.S. Nat Libr Med. [Link].
44. The Efficacy and Safety of Pyramax in Mild to Moderate COVID-19 Patients. U.S. Nat Libr Med. [Link].
45. World Health Organization, WHO Publications, Geneva, March/2020. Disponível em: [Link]. Acesso em: 13 jun. 2020.
46. Lu J-J, Pan W Hu Y-J, Wang Y-T. Multi-Target Drugs: The Trend of Drug Research and development. PLoS ONE. 2012; 7(6): e40262. [CrossRef].
47. Uzor PF. Alkaloids from plants with antimalarial activity: a review of recent studies. BMC Comp Alter Med. 2020; Article ID 8749083 | 17 pages. [CrossRef].
48. Cock IE, Selesho MI, van Vuuren SF. A review of the traditional use of southern African medicinal plants for the treatment of malaria. J Ethnopharmacol. Dec. 2019; 245: 112176. ISSN 0378-8741. [CrossRef] [PubMed].
49. Alesaeidi S, Sepide M. A Systematic Review of Anti-malarial Properties, Immunosuppressive Properties, Anti-inflammatory Properties, and Anti-cancer Properties of Artemisia Annua. Electr Phys. ISSN 2008-5842. Oct. 2016; 8(10): 3150-3155. [CrossRef].
50. Brahmachari G, Gorai D, Roy R. Argemone mexicana: Chemical and pharmacological aspects. Braz J Pharmacogn. 2013; 23(3): 559-75. ISSN 0102-695X. [CrossRef].
51. Chang YC, Hsieh PW, Chang FR, Wu RR, Liaw CC, Lee KH, et al. Two new protopines argemexicaines A and B and the anti-HIV alkaloid 6-acetonyldihydrochelerythrine from Formosan Argemone mexicana. Pl Med. 2003; 69(2): 148-52. [CrossRef] [PubMed].
52. Botsaris AS. Plants used traditionally to treat malaria in Brazil: the archives of Flora Medicinal. J Ethnobiol Ethnomed. 2007; 3: 18. ISSN 1746-4269. [CrossRef] [PubMed].
53. Ehimwenma SO, Anirban P. Antiplasmodial, antioxidant and immunomodulatory activities of ethanol extract of Vernonia amygdalina del. Leaf in Swiss mice. Avicenna J Phytomed. Mar-apr. 2016; 6(2): 236-247. [PubMed].
54. Asante DB et al. Anti-inflammatory, anti-nociceptive and antipyretic activity of Young and old leaves of Vernonia amygdalina. Biomed Pharmaco. 2019; 111: 1187-1203. [CrossRef].
55. Enejoh OS, Ogunyemi IO, Bala MS, Oruene IS, Suleiman MM, FolorunshoAmbali S. Ethnomedical Importance of Citrus aurantifolia (Christm) Swingle. The PharmaInnov J. 2015; 4(8): 1-6. ISSN 2277-7695. [Link].
56. Amorim JL et al. Anti-Inflammatory Properties and Chemical Characterization of the Essential Oils of Four Citrus Species. PLoS ONE 11(4): e0153643. [CrossRef].
57. Mesia K, Tona L, Mampunza MM, Ntamabyaliro N, Muanda T, Muyembe T et al. Antimalarial efficacy of a quantified extract of Nauclea Pobeguinii stem bark in human adult volunteers with diagnose dun complicated Falciparum malaria. Part 2: A clinical phase IIB trial. Planta Med. 2012; 78(9): 853-60. ISSN 0032-0943. [CrossRef] [PubMed].
58. Mbiantcha M, Tsafack EG, Ateufack G, Nana YW, Bomba TFD, Djuichou NSF et al. Analgesic, anti-inflammatory and anti-arthritic properties of aqueous and methanolic stem bark extracts from Nauclea Pobeguinii (Rubiacee) in Rats. J Complement Integr Med. 2018; 15(4): 2017-0140, ISSN 1553-3840. [CrossRef] [PubMed].
59. Donalisio M et al. In vitro anti-Herpes simplex virus activity of crude extract of the roots of Nauclea latifolia Smith (Rubiaceae). BMC Compl Alter Med. 2013; 13: 266. [Link].
60. Singh AK, Pal A, Dutt HK. Antimalarial efficacy of Nyctanthes arbor-tristis and its effect on combination with Artesunate in Plasmodium berghei K173 induced mice model. Int J Res Pharmacol Pharmacother. 2019; 8(1): 1-9. ISSN 2278-2656. [Link].
61. Bharshiv CK, Garg SK, Bhatia AK. Immunomodulatory activity of aqueous extract of Nyctanthes arbor-tristis flowers with particular reference to splenocytes proliferation and cytokines induction. Indian J Pharmacol. 1 Jul. 2016; 48(4): 412-7. [cited 2020 Nov 12]. [CrossRef] [PubMed].
62. Gupta P et al. Antiviral profile of Nyctanthes arbortristis L. against encephalitis causing viroses. Indian J Exp Biol. 2005; 43(12): 1156-60. PMID: 16359127. [Link] [PubMed].
63. Gilbert B, Favoreto R. Quassia amara L. (Simaroubaceae). Rev Fitos. 2010; 5(3): 4-19. ISSN 1808-9569. [Link].
64. Gilbert B, Ferreira J, Alves L. Monografias de plantas medicinais brasileiras e aclimatadas. Quassia amara L. 1ª ed. Abifito e FINEP. 2004; 259: 106.
65. Sá MS, Menezes MN, Krettli AU, Ribeiro IM, Tomassini TCB, Ribeiro RS et al. Antimalarial activity of physalins B, D, F, and G. J Nat Prod. 2011; 74(10): 2269-72. ISSN 0163-3864. [CrossRef][PubMed].
66. Sharma N, Bano A, Dhaliwal HS, Sharma V. A pharmacological comprehensive review on 'Rassbhary' Physalis angulata (L.). Inter J Pharm Pharmac Sci. 2015; 7(8): 34-8. ISSN 0975-1491. Available from: [Link]. [cited 2020 Jun 23].
67. Ayodhyareddy P, Rupa P. Ethno Medicinal, Phyto Chemical and Therapeutic Importance of Physalis angulata L.: A Review. Inter J Sci Res (IJSR). 2016; 5(5): 2122-2127. [Link].
68. Gutierrez MPR, Gonzalez MNA, Hoyo-Vadillo C. Alkaloids from Piper: a review of its phytochemistry and pharmacology. Mini Rev Med Chem. 2013; 13(2): 163-193. ISSN 1389-5575. [CrossRef] [PubMed].
69. Bertol JW et al. Antiviral activity of fractions from leaves of Piper regnelli var. pallescens. Braz J Pharmacog. Nov./Dec. 2012; 22(6): 1290-1294. ISSN 0102-695X. [CrossRef].
70. Abbas J and Syafruddin. Antiplasmodial evaluation of one compound from Calophyllum flavoranulum. Indones J Chem. 2014; 14(2): 185-91. ISSN 1411-9420. [CrossRef].
71. Poonam GD, Manasi SG, Tannaz JB. Psidium guajava: A Single Plant for Multiple Health Problems of Rural Indian Population. Pharmacogn Rev. Jul-Dec 2017; 11(22): 167-174. [CrossRef][PubMed].
72. Khalil H, Abd El Maksoud AI, Roshdey T, El‐Masry S. Guava flavonoid glycosides prevent influenza A virus infection via rescue of P53 activity. J Med Virol. 24 Jan. 2019; 91(1): 45-55. Available from: [Link] [CrossRef] [PubMed].
73. Kasim LS, Olaleye KO, Fagbohun AB, Ibitoye SF, Adejumo OE. Chemical composition and antibacterial activity of essential oils from Struchium sparganophora Linn. Ktze Asteraceae. Adv Biol Chem. 2014; 04(04): 246-52. ISSN 2162-2191. [CrossRef].
74. Madureira MC, Martins PA, Gomes M, Paiva J, Cunha AP, Rosário V. Antimalarial activity of medicinal plants used in traditional medicine in S. Tomé and Príncipe islands. J Ethnopharmacol. 2002; 81(1): 23-9. ISSN 0378-8741. [CrossRef] [PubMed].
75. Aderibige AO, Agboola OI, Eduviere AT. Anti-inflammatory and analgesic properties of Struchium sparganophora Linn leaves in mice. Afr J Med Med Sci. 2015; 44(1): 71-77. [PubMed].
76. Kamboj A, Saluja A. Ageratum conyzoides L.: a review on its phytochemical and pharmacological profile. Int J Green Pharm. 2008; 2(2): 59. [CrossRef].
77. Ogbole et al. In vitro antiviral activity of twenty-seven medicinal plant extracts from Southwest Nigeria against three serotypes of echoviruses. Virol J. 2018; 15(110): ISSN 1743-422X. [CrossRef].
78. Oliveira AMGC. Avaliação de atividade antimalárica e citotóxica de plantas medicinais dos Biomas Caatinga e Amazônico. 115 f. 2011. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Biológicas] - Universidade Federal do Rio Grande do Norte. Natal, RN, 2011. [Link].
79. Soro TY, Néné-bi AS, Zahoui OS, Yapi HF, Traoré F. Anti-inflamatory activity of the fractions of the aqueous extract of Ximenia americana (Linnaeus) (Olacaceae). Inter J Pharm Rev Res. 2015; 5(2): 137-142. ISSN 2248-9207. [Link].
80. Asres K et al. Antiviral Activity Against Human Immunodeficiency Virus Type 1 (HIV-1) and Type 2 (HIV-2) of Ethnobotanically Selected Ethiopian Medicinal Plants. Phytother. Res. 2001; 15: 62-69. [CrossRef] [PubMed].
81. Farias ALF, Rodrigues ABL, Martins RL, Rabelo EM, Farias CWF, Almeida SSMS. Chemical characterization, antioxidant, cytotoxic and microbiological activities of the essential oil of leaf of Tithonia diversifolia (Hemsl) A. Gray (Asteraceae). Pharmac. 2019; 12(1): 34. ISSN 1424-8247. [CrossRef] [PubMed].
82. Upadhyay SN, Kawlni L. Pharmacological Profile of Tithonia diversifolia (Hemsl.) A. Gray: A Comprehensive Review. J Drug Res Ayurvedic Sci. 2017; 2(3): 183-7. [CrossRef].
83. Almonte-Flores DC, Paniagua-Castro N, Escalona-Cardoso G, Rosales-Castro M. Pharmacological and genotoxic properties of polyphenolic extracts of Cedrela odorata L. Juglans regia L. barks in rodents. BMC Comp Alter Med. 2015; Article ID187346. [CrossRef].
84. Khalil H, Abd El Maksoud AI, Roshdey T, El-Masry S. Guava flavonoid glycosides prevent influenza A virus infection via rescue of P53 activity. J Med Virol. 24 Jan. 2019; 91(1): 45-55. Available from: [Link]. [cited 2020 Jun 23].
85. Adeleye, OO, Ayeni OJ, Ajamu, MA. Traditional and medicinal uses of Morinda lucida. J Med Plan Stud. 2018; 6(2): 249-254. [Link].
86. Lawal HO, Etatuvie SO, Fawehinmi AB. Ethnomedicinal and Pharmacological properties of Morinda lucida. J Nat Prod. 2012; 5: 93-99. [Link].
87. Al-Snafi AE. Bioactive components and pharmacological effects of Canna indica-An overview. Inter J Pharmacol Toxicol. 2015; 5(2): 71-75. ISSN 2249-7668. [Link].
88. Kumbhar ST, Patil SP, Une HD. Phytochemical analysis of Canna indica L. roots and rhizomes extract. Biochem Biophys Reports. 2018; 16: 50–5. ISSN 2405-5808. [CrossRef].
89. Thepouyporn A et al. Purification and characterization of anti-HIV-1 protein from Canna indica L. leaves. Southeast Asian J Trop Med Public Health. 2012; 43(5): 1153-1160. [PubMed].
90. Sarje SK et al. A pharmacognostic and pharmacological review on Canna indica Linn. IJRPC. 2019; 9(3): 61-77. [CrossRef] [Link].
91. Oliveira FQ, Andrade-Neto V, Krettli AU, Brandão MGL. New evidences of antimalarial activity of Bidens pilosa roots extract correlated with polyacetylene and flavonoids. J Ethnopharmacol. 2004; 93(1): 39-42. ISSN 0378-8741. [CrossRef] [PubMed].
92. Lucchetti L, Teixeira DF, Barbi NS, Silva AJR. Bidens pilosa (Asteraceae). Rev Fitos. 2009; 4(2): 60-70. Disponível em: [Link].
93. Chiang LC, Chang JS, Chen CC, Ng LT, Lin CC. Anti-Herpes Simplex Virus Activity of Bidens pilosa and Houttuynia cordata. Am J Chin Med. 2003; 31(3): 355-62. [CrossRef] [PubMed].
94. Bartolome AP, Villaseñor IM, Yang WC. Bidens pilosa L. (Asteraceae): Botanical Properties, Traditional Uses, Phytochemistry, and Pharmacology. Hindawi Publ Corp. 2013; 1-51. [CrossRef] [Link].
95. Andrade-Neto VF, Brandão MGL, Nogueira F, Rosário VE, Krettli AU. Ampelozyziphus amazonicus Ducke (Rhamnaceae), a medicinal plant used to prevent malaria in the Amazon Region, hampers the development of Plasmodium bergheis sporozoites. Int J Parasitol. 2008; 38(13): 1505-1511. ISSN 0020-7519. [CrossRef].
96. Peçanha LMT et al. Immunobiologic and Anti-inflammatory Properties of a Bark Extract from Ampelozizyphus amazonicus Ducke. Biomed Res Int. 2013; 2013: 451679. ISSN 2314-6141. [CrossRef].
97. Amaral ACF et al. Updated studies on Ampelozizyphus amazonicus, a medicinal plant used in the Amazonian Region. Pharmacog Rev. 2008; 2(4): 308-316. [Link].
98. Silva LE, Reis RA, Moura EA, Amaral W, Sousa Junior PT. Plantas do Gênero Xylopia: Composição Química e Potencial Farmacológico. Rev Bras Plan Med. 2015; 17(4) Supl.1: 814-826. ISSN 1983-084X. [CrossRef].
99. Phytomedicines Versus Hydroxychloroquine as an Add on Therapy to Azythromycin in Asymptomatic CoVID-19 Patients (PHYTCOVID-19). U.S. Nat Libr Med. 2020. [Link].
100. Camostat and Artemisia Annua vs Placebo in COVID-19 Outpatients. U.S. Nat Libr Med. 2020. [Link].
101. COVID-19: Collecting Measurements of Renin-angiotensin-system Markers, Such as Angiotensin-2 and Angiotensin 1-7 (Tomeka). U.S. Nat Libr Med. 2020 [Link].
102. Rabbani AB, Parikh RV, Rafique AM. Colchicine for the Treatment of Myocardial Injury in Patients with corona virus disease 2019 (COVID 91) - An old drug with new life? JAMA Network Open. 2020; 3(6): e2013556. [CrossRef].
103. Deftereos SG, Giannopoulos G, Vrachatis DA et al. GRECCO-19 Investigators. Effect of colchicine vs standard care on cardiac and inflammatory biomarkers and clinical outcomes in patients hospitalized with coronavirus disease 2019: the GRECCO-19 randomized clinical trial. JAMA Netw Open. 2020; 3(6): e2013136. [CrossRef] [PubMed].
104. Borquaye LS et al. Alkaloids from Cryptolepis sanguinolenta as potential inhibitors of SARS-CoV-2 viral proteins: an in-silico study. BioMed Res Inter. 2020; 2020: Article ID 5324560, 14 pages. [CrossRef] [PubMed].
105. Pandeyaa KB, Ganeshpurkarb A, Mishrac MK. Natural RNA dependent RNA polymerase inhibitors: Molecular docking studies of some biologically active alkaloids of Argemone mexicana. Med Hypot. 2020; 144: 109905. [CrossRef] [PubMed].
106. Gutierrez-Villagomez JM, Campos-García T, Molina-Torres J, Lopez MG, Vazquez-Martínez JC. Alkamides and Piperamides as Potential Antivirals against the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). J Phys Chem Lett. 2020; 11: 8008-8016. [CrossRef] [PubMed].
107. Musfiroh I, Azura AR, Rahayu D. Prediction of Asiatic Acid Derivatives Affinity Against SARS-CoV-2 Main Protease Using Molecular Docking. Pharmac Sci Res (PSR). 7(Special Issue on COVID-19). 2020; 57-64. [CrossRef].
108. Zhou et al. Network-based drug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. Cell Discov. 2020; 6: 14. [CrossRef] [Link].