ARTIGO DE PESQUISA
Ação antioxidante de espécies vegetais nativas do Brasil: uma revisão integrativa
Antioxidant action of native vegetables species of Brazil: a integrative review
Resumo
Radicais livres consomem elétrons de outras moléculas adjacentes, alterados e comprometendo as estruturas dessas moléculas, causando oxidação e envelhecimento precoce. Diversas doenças estão associadas ao estresse oxidativo, como doença de Parkinson, Alzheimer, aterosclerose. Tendo em vista a diversidade da flora brasileira, o presente trabalho buscou abordar, através da literatura, estudos sobre a capacidade antioxidante de espécies nativas brasileiras. Para tanto, foram analisados 15 estudos selecionados em fontes primárias de pesquisa. Os estudos selecionados apontaram que espécies como Anadenanthera peregrina e Plinia cauliflora representam uma alternativa na obtenção de compostos antioxidantes, devido a presença de compostos fenólicos. Concluiu-se pela necessidade de novos estudos, para extrair e isolar esses compostos, a fim de aplicar na indústria farmacêutica e cosmética de forma segura.
- Palavras-chave:
- Elementos de resposta antioxidantes.
- Flora brasileira.
- Antioxidantes.
- Compostos fenólicos.
Abstract
Free radicals consume electrons from other adjacent molecules, altered and compromising the structures of these molecules, causing oxidation and premature aging. Several diseases are associated with oxidative stress, such as Parkinson's disease, Alzheimer's, atherosclerosis. In view of the diversity of the Brazilian flora, the present sought to address through the literature studies on the antioxidant capacity of native Brazilian species. To this end, 15 studies selected from primary research sources were analyzed. The selected studies pointed out that species such as Anadenanthera peregrina and Plinia cauliflora represent an alternative in obtaining antioxidant compounds, due to the presence of phenolic compounds. Further studies are needed to extract and isolate these compounds to apply in the pharmaceutical and cosmetic industry safely.
- Keywords:
- Antioxidant response elements.
- Brazilian flora.
- Antioxidants.
- Phenolic compounds.
Introdução
Desde os tempos antigos, o ser humano tem buscado na natureza meios para melhorar sua saúde e aumentar suas chances de sobrevivência. Em todas as culturas e épocas, a humanidade utilizou os recursos naturais para satisfazer suas necessidades. Em países em desenvolvimento, a medicina tradicional e a fitoterapia são amplamente utilizadas para manter as condições de saúde[1].
Através da fitoquímica foi-se descobrindo e isolando as estruturas moleculares das substâncias ativas, provenientes do metabolismo das plantas, que foram introduzidas na terapêutica e sendo utilizadas na produção de medicamentos de origem natural, em alternativa aos medicamentos de origem sintética[2].
Na busca por prevenir doenças, a indústria farmacêutica e cosmética voltou seus estudos para obter compostos antioxidantes, visto que o estresse oxidativo pode estar relacionado a diversas doenças. Os estudos dos compostos fenólicos obtidos de plantas demostraram ser uma alternativa, os compostos fenólicos podem ser divididos em dois grandes grupos, os flavonoides e os não flavonoides[3].
Compostos fenólicos e em destaque os flavonoides, possuem alto potencial antioxidante incluindo o sequestro e neutralização dos radicais livres, esses compostos são formados no metabolismo secundário dos vegetais e possuem funções de defesa contra pragas. Em animais e humanos são capazes de reagir com radicais livres, formando radicais estáveis. Essa capacidade de neutralizar as estruturas radiculares dos compostos fenólicos é devido à sua estrutura química formada por pelo menos um anel aromático com grupamentos hidroxilas[4].
Os antioxidantes podem ser aplicados em processos oxidativos, uma vez que a oxidação resulta na produção de radicais livres (O-2, OH, H2O2) durante o metabolismo e a respiração em organismos aeróbicos[5].
Os métodos de avaliação da atividade antioxidante podem ser classificados de acordo com o mecanismo de reação: métodos baseados nas reações de transferência de elétrons (como o ABTS, DPPH e FRAP), e métodos baseados nas reações de transferência de átomos de hidrogênio[6].
A atividade antioxidante de compostos fenólicos ocorre pelo poder redutor do grupo hidroxila aromático, que reduz radicais livres reativos e produz o radical fenoxila estabilizado por ressonância. O número de grupos hidroxila e a posição também são determinantes para sua atividade[7].
Tendo em vista a necessidade de estudar novos compostos obtidos de vegetais que podem atuar como agente antioxidante, o presente estudo objetivou abordar através de uma revisão de literatura quais plantas nativas do Brasil, possuem compostos antioxidantes e como são os mecanismos de ação antioxidante desses compostos, a fim de elevar os conhecimentos sobre substâncias antioxidantes presentes em espécies vegetais brasileiras.
Material e Método
Trata-se de uma revisão integrativa da literatura (RI), e indispensável não somente para definir bem o problema, mas também para obter uma ideia precisa sobre o estado atual dos conhecimentos sobre um dado tema, as suas lacunas e a contribuição da investigação para o desenvolvimento do conhecimento. A revisão integrativa da literatura é um método que consiste em analisar de forma crítica, estudos anteriores sobre a temática selecionando-os de acordo com as fases organizativas que permitem analisar e avaliar os dados coletados[8,9].
O tema de interesse e pergunta condutora foi: "Quais as principais espécies vegetais comuns no Brasil são estudadas como possível agente antioxidante?".
Tendo em vista a pergunta norteadora, foi realizada uma busca, ocorrida entre dezembro de 2022 e janeiro de 2023, em 5 bases de dados: Scopus, Embase, Web of Science, PubMed e Science Direct. As bases de dados foram acessadas através do Portal de Periódicos CAPES.
A pesquisa por artigos foi feita através dos conjuntos de termos em língua inglesa e portuguesa: ("antioxidant response elements" AND "phytochemicals" AND "phytotherapy") OR ("herbal medicine" AND "Brazil" AND "antioxidant activity" AND "Brazilian plant species") OR ("inhibition" AND "free radicals" AND "metal complexation").
Para seleção dos estudos foram aplicados critérios de inclusão e exclusão. Foram incluídos artigos publicados entre 2018 e 2023, em qualquer idioma, dentro do sistema open access e que respondessem o objetivo do estudo. Artigos duplicados, incompletos, resumos de trabalhos, trabalhos publicados em anais de eventos, resenhas de livros, livros, capítulos de livros, estudo fora do sistema open access e artigos que não respondiam o objetivo do estudo, foram excluídos.
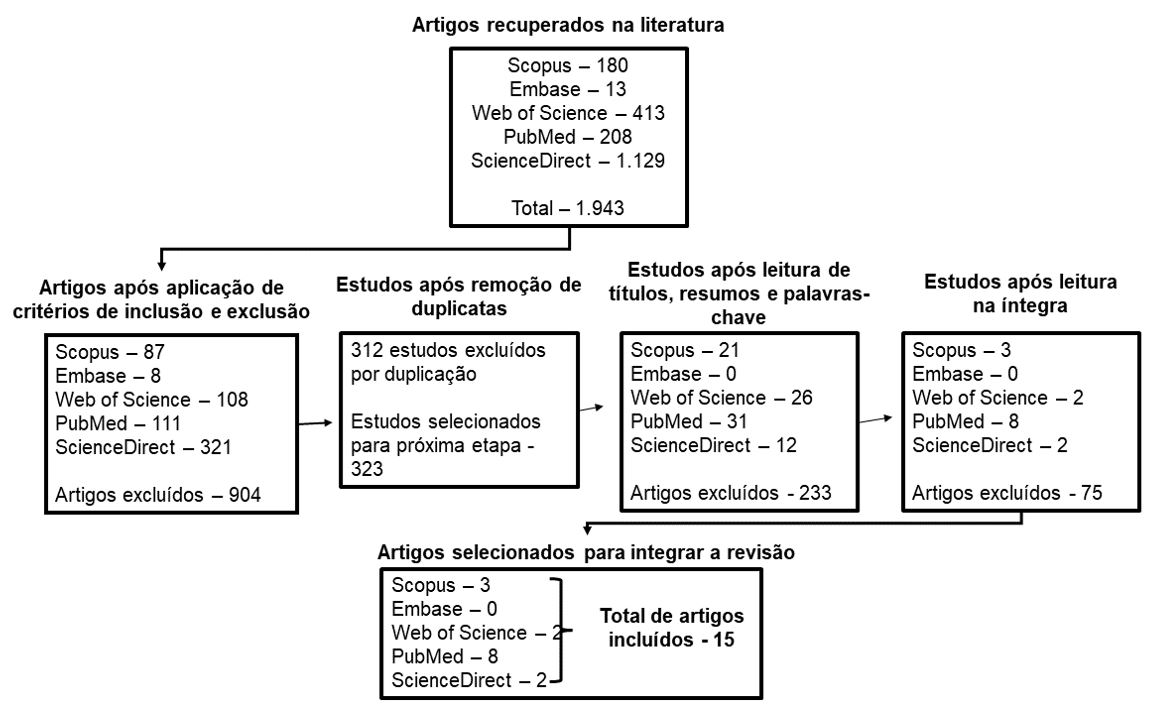
Após a aplicação dos critérios de inclusão e exclusão, os dados obtidos tiveram sua RIS (Reference Manager) exportadas e adicionadas ao software gratuito Ryyan (https://www.ryyan.ai/), como proposto por Ouzzani at al.[10], para remoção de duplicatas, em caso de estudos duplicados se deu preferência de inclusão ao estudo encontrado primeiro, independente a qual base de dado esteja indexado. A seleção foi realizada por dois pesquisadores independentes, previamente treinados para avaliar e aplicar de testes de relevância (FIGURA 1).
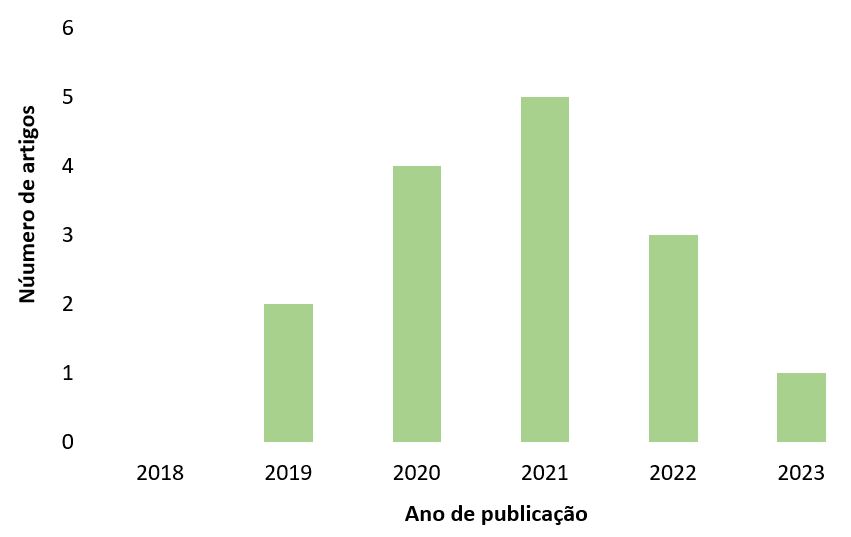
Com auxílio do Rayyan os estudos foram selecionados através da leitura dos títulos, resumos e palavras-chave e, posteriormente, da leitura na íntegra. Os principais resultados obtidos com a análise dos artigos foram dispostos em planilha do Microsoft Excel para serem utilizados na elaboração do estudo. Os artigos selecionados compreendem a um período de 6 anos (2018-2023), sendo 2021 o ano com mais publicações (5) (GRÁFICO 1).
Resultados e Discussão
No que se refere aos artigos analisados nesse estudo (TABELA 1), observa-se plantas da região amazônica, cerrado, caatinga e mata atlântica, com alto potencial antioxidante. No escopo desse estudo observou-se que os métodos de estudo para agentes antioxidantes de dividem entre óleos essenciais[11,12,24], extratos etanólicos[13,15,17,18,23] e extratos hidroetanólico[14,16,25].
| Espécie | Nome Popular | Extrato/Fração/Isolado | Fitoquímica | Referência |
| Psidium cattleianum | Araçá-rosa | Óleo essencial das folhas | β -cariofileno α -humuleno | [11] |
| Xylopia emarginata | Pindaíba-d'água | Óleo essencial das folhas | β-pineno, α-pineno e biciclogermacreno | [12] |
| Licania tomentosa | Oiti | Extrato etanólico de sementes | Ácido hidroxi-jasmónico- O -hexosídeo e ácido ferúlico | [13] |
| Anadenanthera peregrina | Angico | Extrato hidroetanólico de cascas do caule | Ácido gálico | [14] |
| Plinia cauliflora | Jaboticaba | Extratos etanólicos de folhas e ramos | Quercetina, quercitrina e miricitrina | [15] |
| Brosimum gaudichaudii | Mama-cadela | Extrato hidroetanólico de frutos | Calcomoracina, artocarpin e 3′-O-metiluteolina | [16] |
| Ocotea notata | Ocotea | Extratos etanólicos de folhas | Quercetina, miquelianina e isoquercitrina | [17] |
| Kielmeyera coriacea | Pau-santo | Extrato etanólico de cascas | Quercetina | [18] |
| Myrcia splendens | Guapiciquí-mirim | Extrato etílico de folhas | NR* | [19] |
| Philodendron megalophyllum | Cipó-de-tracuá | Extrato aquoso do caule | NR | [20] |
| Cereus peruvianus | Cacto-do-peru | Extratos do cladódio | Isorhamnetin 3- O -rutinósido e tiramina | [21] |
| Pilosocereus pachycladus | Facheiro | Extrato fenólico metil do fruto | Betacianinas e ácido ascórbico | [22] |
| Cordia glabrata | Claraíba | Extrato etanólico de folhas | Ácidos p -cumárico e esteárico | [23] |
| Calyptranthes concinna | Araçarana | Óleo essencial de folhas | Elemicina, β-cariofileno e germacreno B | [24] |
| Dalbergia ecastaphyllum | Rabo-de-bugio | Extrato hidroetanólico de folhas e caule | Catequina, pinocembrina, naringina e rutina | [25] |
| *NR-Não Relatado | ||||
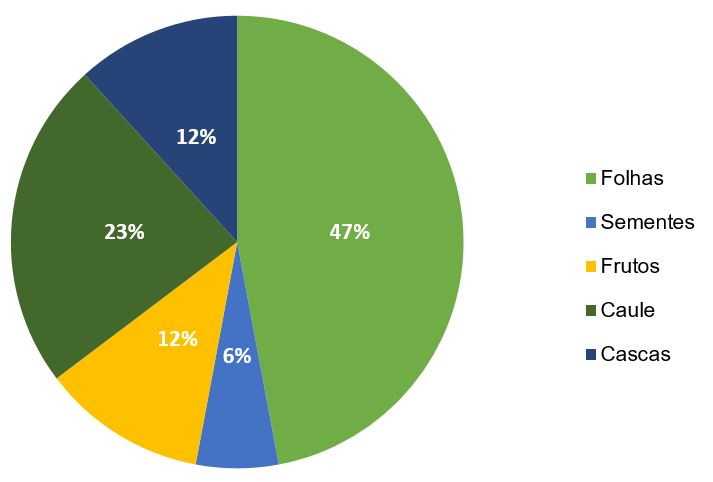
Ao que se refere a parte da planta estudada, o uso de folhas se destaca, 47% dos estudos analisados utilizam as folhas como principal fonte de compostos antioxidantes, seguido por uso do caule (23%) (GRÁFICO 2).
Apresentado na TABELA 1, espécies vegetais de diferentes biomas brasileiros estão relacionadas a possíveis atividades antioxidantes, por possuírem compostos fenólicos, como o flavonoide quercetina, que são descritos em 3 estudos de Lima at al.[15], Pereira at al.[17] e Justino at al.[18], selecionados para compor a revisão. A quercetina é relatada como um dos principais componentes de agente antioxidante presente nas espécies Plinia cauliflor, Kielmeyera coriacea e Ocotea notata.
Estudos analisando a atividade antioxidante da Psidium cattleianum (Araça-rosa) demostram que, frente a diferentes métodos, a atividade antioxidante é eficaz. Nos métodos de testes ABTS, ABTS EC50, DPPH e TEAC a Psidium cattleianum demostra atividade antioxidante que variam de 40.11 μg/mL para o método DPPH, a 156 μM/g para TEAC[11,26-29].
Testes de avaliação antioxidante com óleo essencial de Psidium cattleianum sugerem que o padrão AA foi o mais eficaz na redução de Fe3+ em ensaio FRAP, com concentração de 22,4 e 90 µg/mL. Ensaios ABTS e DPPH também demostram valores consideráveis de 45 e 90 µg/mL, respectivamente. A atividade antioxidante da P. cattleianum está relacionada a presença do composto β-cariofileno, já descrito como agente antioxidante em outros estudos[30,31].
Marinho at al.[14] analisou a capacidade antioxidante da Anadenanthera peregrina (Angico), os testes demostraram que a atividade antioxidante expressa em IC50 foi de 44,13 mg/mL-1 para o extrato. A análise do extrato por cromatografia líquida de alta eficiência (HPLC) mostrou que a atividade antioxidante está relacionada a presença de compostos fenólicos, tendo teor total de compostos fenólicos de 6,40 g GAE 100 g-1 extrato. A HPLC demostra presença de ácido gálico (Rt 6,735 min), catequina (Rt 16,375 min) e epicatequina (Rt 21,335 min). Os resultados de Marinho at al.[14], são semelhantes aos estudos de Mota at al.[32], onde descrevem atividade antioxidante de 238 mg Trolox/g, e 583 mg GAE/g extrato, de fenólicos totais.
A presença de compostos fenólicos justifica a atividade antioxidante em diversas espécies. Extrato hidroalcóolico da folha da Eugenia uniflora analisado demostra atividade antioxidante, devido a presença de e 2284,31 mg de rutina por 100 mL/extrato, outros estudos já identificaram a presença dos compostos quercetina e quercetina-pentosídeo, que são agentes antioxidantes comprovados[33,34] .
A espécie Microgramma vacciniifolia de ampla distribuição na flora brasileira também entra no grupo de espécies com ação antioxidante devido a presença de compostos fenólicos. Estudo de Silva at al.[35] identificou na sua fitoquímica a presença de polifenóis, flavonoides e terpenos. A atividade antioxidante mensurada através de ensaio com 2,2-difenil-1-picril-hidrazil (DPPH), revelou taxas de CE50 38,7μg mL-1 para o extrato hidroalcóolico.
O potencial antioxidante do extrato hidroetanólico dos frutos de B. gaudichaudii investigado contra o radical livre 2,2-difenil-1-picril-hidrazil (DPPH), demostra que o aumento da concentração aumenta a taxa de inibição, alcançando os primeiros níveis de inibição em concentração 6,25 μg mL-1 (inibição de 4,72 ± 1,05%), e alcançando inibição máxima de 44,87 ± 0,45%, na concentração de 800 μg mL-1. Outros estudos demostram que extratos de mama-cadela atingem taxas de inibição entre 26,46, 28,85 ± 2,66%[16,36].
Conclusão
Após a análise dos resultados dos estudos que compõem a revisão, foi possível observar que diversas espécies nativas brasileiras são viáveis como produtos antioxidantes. A diversidade de espécies brasileiras, distribuídas nos diferentes biomas brasileiros representam uma alternativa na formulação farmacêutica e cosmética de produtos com agentes antioxidantes. O uso de espécies como a Psidium cattleianum e Anadenanthera peregrina, na obtenção de agentes antioxidantes é uma alternativa viável, devido a presença de compostos fenólicos, com destaque para compostos como o ácido gálico e β -cariofileno, que estão ligados diretamente na degradação de radicais livre oxidativos.
Para garantir o uso seguro de plantas medicinais, é essencial desenvolver mais estudos clínicos e experimentais para analisar possíveis efeitos adversos e determinar as dosagens adequadas. Nesse sentido, este trabalho contribui para aprofundar e desenvolver novas reflexões sobre o estudo de espécies nativas brasileiras como fonte de compostos antioxidantes.
Fontes de Financiamento
Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico - FUNCAP.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico - FUNCAP.
Colaboradores
Concepção do estudo: ARSPR; CDCA.
Curadoria dos dados: ARSP; CDCA.
Coleta de dados: ARSPR; CDCA.
Análise dos dados: ARSPR; CDCA
Redação do manuscrito original: ARSPR; CDCA
Redação da revisão e edição: ARSPR; CDCA
Referências
1. Unesco. Organização das Nações Unidas Para a Educação, a Ciência e a Cultura. Culture and Health: Orientation Texts: World Decade for Cultural Development. Paris, 1996. [https://unesdoc.unesco.org/ark:/48223/pf0000081721]. [acesso em: 21 jan. 2023].
2. Ferrera, TS, Heldwein AB, Dos Santos CO, Somavilla JC, Sautter CK. Substâncias fenólicas, flavonoides e capacidade antioxidante em erveiras sob diferentes coberturas do solo e sombreamentos. Rev Bras Pl Med. 2016; 18(supl. 2): 588-596. ISSN 1516-0572. [https://doi.org/10.1590/1983-084X/15_197].
3. Martins SJ, Paulino BMLV, Almeida AAS, Pavão JMDSJ. Prospecção fitoquímica e determinação do potencial antioxidante in vitro da Licania tomentosa (Benth.). Diversitas J. 2021; 6(2): 2099-2108. ISSN 2525-5212. [https://doi.org/10.17648/diversitas-journal-v6i2-908].
4. Giada MDLR, Filho MJ. Importância dos compostos fenólicos da dieta na promoção da saúde humana. Publ UEPG: Ciên Biol Saúde. 2006; 12(4): 7-12. ISSN 1676-8485. [https://doi.org/10.5212/publicatio uepg.v12i4.439].
5. Lemes AC, Sala L, Ores JDC, Braga ARC, Egea MB, Fernandes KF. A review of the latest advances in encrypted bioactive peptides from protein-rich waste. Int J Mol Sci. 2016; 17(6): 950. ISSN 1422-0067. [https://doi.org/10.3390/ijms17060950].
6. Huang D, Ou B, Prior RL. The chemistry behind antioxidant capacity assays. J Agric Food Chem. 2005; 53(6):1841-1856. ISSN 0021-8561 [https://doi.org/10.1021/jf030723c].
7. Cerqueira FM, Medeiros MHGD, Augusto O. Antioxidantes dietéticos: controvérsias e perspectivas. Quim Nova. 2007; 30(2): 441-449. ISSN 1678-7064. [https://doi.org/10.1590/S0100-40422007000200036].
8. Garuzi M, Achitti COM, Sato CA, Rocha AS, Spagnuolo RS. Acolhimento na Estratégia Saúde da Família: revisão integrativa. Rev Panam Salud Publ. 2014; 35(2): 144-149. ISSN 1020-4989. [https://www.scielosp.org/article/rpsp/2014.v35n2/144-149].
9. Crossetti MDGO. Revisão integrativa de pesquisa na enfermagem o rigor científico que lhe é exigido. Rev Gaucha Enferm. 2012; 33(2):8-9. ISSN 0102-6933. [https://doi.org/10.1590/S1983-14472012000200001].
10. Ouzzani M, Hammady H, Fedorowicz Z, Elmagarmid A. Rayyan—a web and mobile app for systematic reviews. System Rev. 2016; 5(210): 1-10. INSS 2046-4053. [https://doi.org/10.1186/s13643-016-0384-4].
11. Ferreira MJG, Linhares RM, Oliveira SM, Camilo CJ, Martins CJG, Almeida SM. Therapeutic indications, chemical composition, and biological activity of native Brazilian species from Psidium genus (Myrtaceae): a review. J Ethnopharmacol. 2021; 278(5); 114248. ISSN 1872-7573. [https://doi.org/10.1016/j.jep.2021.114248].
12. Cascaes MM, De Moraes ÂAB, Cruz JN, Franco CJP, Silva ERC, Nascimento LDD et al. Phytochemical profile, antioxidant potential and toxicity evaluation of the essential oils from Duguetia and Xylopia Species (Annonaceae) from the Brazilian Amazon. Antioxidants. 2022; 11(9): 1709. ISSN 2076-3921. [https://doi.org/10.3390/antiox11091709] [https://pubmed.ncbi.nlm.nih.gov/36139777/].
13. Lima MJ, Silva AT, Neto JLJ, Filho CPAL, Ribeiro RVP, Sousa BE et al. Chemical composition, nutritional properties, and antioxidant activity of Licania tomentosa (Benth.) fruit. Food Chem. 2020; 313: 126117. ISSN 0308-8146. [https://doi.org/10.1016/j.foodchem.2019.126117].
14. Marinho TA, Oliveira MG, Menezes-Filho ACP, Castro CFS, Oliveira IMM, Borges LL et al. Phytochemical characterization, and antioxidant and antibacterial activities of the hydroethanolic extract of Anadenanthera peregrina stem bark. Braz J Biol. 2021; 82: e234476. ISSN 1519-6984. [https://doi.org/10.1590/1519-6984.234476].
15. de Lima PP, de Oliveira LAS, Campos LM, Ferreira TG, Freitas ST, Queiroz LS et al. Pharmacological investigation of antioxidant and anti-inflammatory activities of leaves and branches extracts from Plinia cauliflora (Jaboticaba). J Ethnopharmacol. 2021; 280: 114463. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2021.114463].
16. Mickely W, Engelbrecht L, Vicente RR, Yoshida CN, Dos Santos GV, Pavan E et al. Chemical characterization, antioxidant and cytotoxic activities of the edible fruits of Brosimun gaudichaudii Trécul, a native plant of the Cerrado. Biomed Chem Biodivers. 2021; 18(7): e2001068. ISSN 1612-1872. [https://doi.org/10.1002/cbdv.202001068] [https://pubmed.ncbi.nlm.nih.gov/33998146/].
17. Pereira RV, Mecenas AS, Malafaia CRA, Amaral ACF, Muzitano MF, Simas NK et al. Evaluation of the chemical composition and antioxidant activity of extracts and fractions of Ocotea notata (Ness) Mez (Lauraceae). Nat Prod Res. 2020; 34(20): 3004-3007. ISSN 1478-6419. [https://doi.org/10.1080/14786419.2019.1602828].
18. Justino AB, Santana EC, Franco RR, Queiroz JS, Silva HCG, Júnior de Lima JP et al. Antioxidant compounds of Kielmeyera coriacea Mart. with α-amylase, lipase and advanced glycation end-product inhibitory activities. J Pharm Biomed Anal. 2021; 206: 114387. ISSN 0731-7085. [https://doi.org/10.1016/j.jpba.2021.114387].
19. Pontes FC, Abdalla VCP, Imatomi M, Fuentes LFG, Gualtieri SCJ. Antifungal and antioxidant activities of mature leaves of Myrcia splendens (Sw.) DC. Braz J Biol. 2019; 79(1): 127-132. ISSN 1519-6984. [https://doi.org/10.1590/1519-6984.179829].
20. Guimarães CN, Freitas SLA, de Souza MCS, de Almeida PDO, Dos Santos MC, Nunez CV et al. Evaluation of the anti-snakebite, antimicrobial and antioxidant potential of Philodendron megalophyllum Schott (Araceae), traditionally used in accidents caused by snakes in the western region of Pará, Brazil. Toxicon. 2020; 184: 99-108. ISSN 0041-0101. [https://doi.org/10.1016/j.toxicon.2020.05.024].
21. Costa NAR, Mangolin CA, Oliveira AJB, Gonçalves RAC, Silva AA, Almeida RTR et al. Cereus peruvianus Mill. (Cactaceae) as a source of natural antioxidants: phenolic compounds and antioxidant activity of cladode extracts in two collection periods. Curr Res Nutr Food Sci. 2022; 5: 984-991. ISSN 2665-9271. [https://doi.org/10.1016/j.crfs.2022.05.014].
22. Rodrigues TDL, Sousa ASBD, Silva MCAD, Nascimento RDS, Sousa FDARD, Silva SDM. Quality, antioxidant and enzymatic activities of facheiro (Pilosocereus Pachycladus Ritter) fruits during maturation. Rev Caatinga. 2020; 32(4): 1092-1103. ISSN 0100-316X. [https://doi.org/10.1590/1983-21252019v32n426rc].
23. Debiasi BW, Raiser AL, Dourado SHA, Torres MPR, Andrighetti CR, Bonacorsi C et al. Phytochemical screening of Cordia glabrata (Mart.) A.DC. extracts and its potential antioxidant, photoprotective, antimicrobial and antiviral activities. Braz J Biol. 2023; 83. ISSN 1519-6984. [https://doi.org/10.1590/1519-6984.248083].
24. Antonelo FA, Rodrigues MS, Wagner JA, Montanher PF. Chemical composition and antioxidant activity of leaf essential oil from Calyptranthes concinna DC. (myrtaceae). Acta Sci Biol Sci. 2022; 44: e62438. ISSN 1807-863X. [https://doi.org/10.4025/actascibiolsci.v44i1.62438].
25. Lucas CIS, Ferreira AF, Carvalho CMAP, Lima SF, Estevinho LM, Carvalho CAL. Phytochemical study and antioxidant activity of Dalbergia ecastaphyllum. Rodriguesia. 2020; 71. ISSN 0370-6583. [https://doi.org/10.1590/2175-7860202071049].
26. Dalla NC, Jablonski A, Rios ADO, Hertz PF, de Jong EV, Flôres SH. The characterisation and profile of the bioactive compounds in red guava (Psidium cattleyanum Sabine) and guabiju (Myrcianthes pungens (O. Berg) D. Legrand). Int J Food Sci. 2014; 49(8): 1842-1849. ISSN 2356-7015. [https://doi.org/10.1111/ijfs.12493].
27. Chaves VC, Boff L, Vizzotto M, Calvete E, Reginatto FH, Simões CM. Berries grown in Brazil: anthocyanin profiles and biological properties. J Sci Food Agric. 2018; 98(11): 4331-4338. ISSN 1097-0010. [https://doi.org/10.1002/jsfa.8959].
28. Saber FR, Abdelbary GA, Salama MM, Saleh DO, Fathy MM, Soliman FM. UPLC/QTOF/MS profiling of two Psidium species and the in-vivo hepatoprotective activity of their nano-formulated liposomes. Food Res Int. 2018; 105: 1029-1038. ISSN 0963-9969. [https://doi.org/10.1016/j.foodres.2017.12.042].
29. Biegelmeyer R, Andrade JMM. Aboy AL, Apel MA, Dresch RR, Marin R, Henriques AT. Comparative analysis of the chemical composition and antioxidant activity of red (Psidium cattleianum) and yellow (Psidium cattleianum var. lucidum) strawberry guava fruit. J Food Sci. 2011; 76(7): C991-C996. ISSN 1750-3841. [https://doi.org/10.1111/j.1750-3841.2011.02319.x].
30. Souza WFC, Lucena FA, Castro RJS, Oliveira CP, Quirino MR, Martins LP. Exploiting the chemical composition of essential oils from Psidium cattleianum and Psidium guajava and its antimicrobial and antioxidant properties. J. Food Sci. 2021; 86(10): 4637-4649. ISSN 1750-3841. [https://doi.org/10.1111/1750-3841.15889].
31. Dahham SS, Tabana YM, Iqbal MA, Ahamed MBK, Ezzat MO, Majid ASA et al. The anticancer, antioxidant and antimicrobial properties of the sesquiterpene β-caryophyllene from the essential oil of Aquilaria crassna. Molecules. 2015; 20(7): 11808–11829. ISSN 1420-3049. [https://doi.org/10.3390/molecules200711808].
32. Mota GS, Sartori CJ, Miranda I, Quilho T, Mori FA, Pereira H. Bark anatomy, chemical composition and ethanol-water extract composition of Anadenanthera peregrina and Anadenanthera colubrina. PloS One. 2017; 12(12): e0189263. ISSN 1932-6203. [https://doi.org/10.1371/journal.pone.0189263].
33. Gama CL, Arriola NDA, Dias CO, Freire CBF, Ribeiro DHB. Caracterização do extrato hidroalcóolico de folhas da pitangueira (Eugenia uniflora L.) de cultivo hidropônico quanto à capacidade antioxidante e potencial antimicrobiano. Braz J Dev. 2022; 8(1): 4316-4331. ISSN 2525-8761. [https://doi.org/10.34117/bjdv8n1-286].
34. Souza PSOD, Santos MTD, Monteiro RG, Espindola,MTA, Souza H JSD, Monteiro ALB et al. Taninos e flavonoides das flores de Eugenia uniflora (Myrtaceae). Quím Nova. 2022; 45(9): 1083-109. ISSN 0100-4042. [https://doi.org/10.21577/0100-4042.20170920].
35. Silva SJ, Ferreira LRD, Silva LV, Conceição SR, Oliveira AM, Soares LAL, Silva GC. Prospecção fitoquímica e avaliação dos potenciais citotóxico e antioxidante do extrato das folhas de Microgramma vaccinnifolia. Braz J Dev. 2020; (4): 20318-20331. ISSN 2525-8761. [https://doi.org/10.34117/bjdv6n4-271].
36. Coutinho AM, dos Santos LGDJ, Damasceno EMA, Soares NZD. Determinação dos fenóis totais e da atividade antioxidante da Brosimum gaudichaudii. Braz J H Pharm. 2019; 1(3): 28-33. ISSN 2596-321X. [https://www.bjhp.crfmg.org.br/crfmg/article/view/71].